Las mezclas de sustancias gaseosas son algunas de las más fáciles de lograr, pues es muy factible que se mezclen sustancias que están en este estado de agregación. Por ejemplo: mezcla de neón, argón y xenón, insecticida en aerosol, aire y helio.
Prácticamente se pueden combinar todos los gases ilimitadamente, claro que condicionado por algunos aspectos químicos, físicos y fundamentalmente relacionados con la seguridad del usuario que los manipula. Al igual que los diferentes tipos de mezclas que se establecen entre las sustancias, las mezclas de gases también cuentan con propiedades que les son únicas.
El estudio de las mezclas gaseosas suele ser tan útil como el de los gases en su estado puro: el mismo conocimiento sobre el aire que está presente en la atmósfera sería imposible si no fuera por el conocimiento sobre proporciones y comportamientos de gases mezclados.
De esta manera, es imprescindible conocer algunas características de las mezclas de los gases, como es la propiedad de la presión parcial (aquella que ejerce cada uno de los gases dentro de la mezcla) y la de la fracción molar (relación entre el número de moles de un componente gaseoso con el del total de la mezcla gaseosa). Los moles expresan la cantidad de gas que hay en la mezcla.
La Ley de Dalton afirma que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de cada uno de los gases individuales que participan en ella (esto está sujeto a que los gases no reaccionen entre sí). La presión parcial se entiende aquí como la que ejercería cada uno de los gases si se encontrase solo en el mismo recipiente y bajo las mismas condiciones de temperatura. Así:
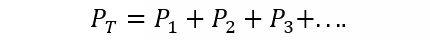
Donde PT es la presión total y P1, P2 y P3 son las presiones parciales de los gases hipotéticos 1, 2 y 3 en la mezcla gaseosa.
Utilizando la Ley de Dalton se desarrolló una expresión para calcular la presión parcial de un gas en una mezcla gaseosa si sabemos su presión total y su fracción molar.
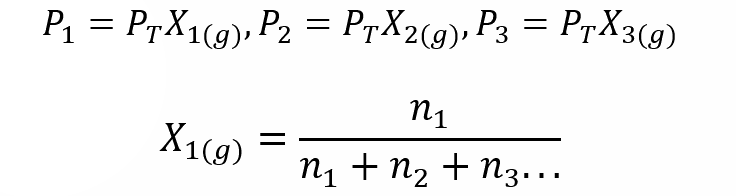
Donde X1, X2 y X3 son las fracciones molares de los gases hipotéticos 1, 2 y 3 en la mezcla gaseosa, y n1, n2 y n3 son las cantidades de sustancia de cada uno de estos gases en la misma mezcla.
Una de las principales propiedades de los componentes en las mezclas es la concentración, que puede expresarse en diferentes unidades. En el caso de las mezclas de gases, la concentración de sus componentes se puede expresar en ppm (partes por millón), unidad referida a su volumen. Es decir, cierta cantidad de ppm de un componente en una mezcla de gases es la relación entre el volumen de esa cierta cantidad respecto al volumen de cada millón de unidades de mezcla.
Es importante tener en cuenta que los ppm de un gas dependen de la temperatura y la presión del gas. Por esta razón, para calcular los ppm de un gas suelen utilizarse las condiciones normales de presión y temperatura (CNPT), que dan por estado normal a los 0 grados Celsius de temperatura, y los 1013 hectopascales (1 bar) de presión. Si no se usan estas condiciones, se deben especificar cuáles se emplearán.
Puede servirte:
Ejemplos de mezclas de gases
La siguiente lista contiene mezclas de gases, explicitando los elementos que aparecen en la mezcla:
- Aire (mezcla de 21% de oxígeno y 79% de nitrógeno, más otros gases en pequeñas proporciones)
- Cronigón (mezcla de 99% argón y 1% oxígeno)
- Trimix (mezcla de oxígeno, nitrógeno y helio)
- Mezcla de neón, argón y xenón
- Mezcla de 85% metano, 9% etano, 4% propano y 2% butano.
- Hexafluoruro de azufre y aire
- Insecticida en aerosol
- Aire y helio
- Nitrox (mezcla de aire, enriquecido en oxígeno y nitrógeno)
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)