Índice
La difusión y ósmosis son procesos de transporte pasivo (no requieren energía extra para ocurrir, al contrario del transporte activo) de partículas de una o varias sustancias que se encuentran en distintas concentraciones de soluto y se ponen en contacto entre sí, ya sea a través de una membrana semipermeable (caso particular de la ósmosis) o de algún otro medio.
¿Qué es la difusión?
La difusión es un proceso físico que se fundamenta en el flujo de partículas de una sustancia desde una zona de alta concentración de soluto hacia una de baja concentración, hasta que la concentración es aproximadamente la misma en ambas zonas. El movimiento de las partículas está basado en su energía cinética, es decir, no existe un aporte externo de energía para que ocurra la difusión. Por ejemplo: el paso del oxígeno en los alvéolos pulmonares.
Este movimiento se produce en cualquiera de los estados de agregación de la materia, pero se observa con mayor facilidad en el caso de los líquidos y gases. La tendencia del movimiento es hacia la formación de una mezcla uniforme de los dos tipos de partículas.
El científico Adolf Fick estableció en 1855 algunas leyes que llevan su nombre, y describen diversos casos de la difusión de la materia en un medio en el que inicialmente no existe equilibrio. Estas leyes relacionan la densidad del flujo de las partículas con la diferencia de concentración entre los dos medios separados, su coeficiente de difusión y la permeabilidad de la membrana (en caso de que el medio separador sea una membrana semipermeable).
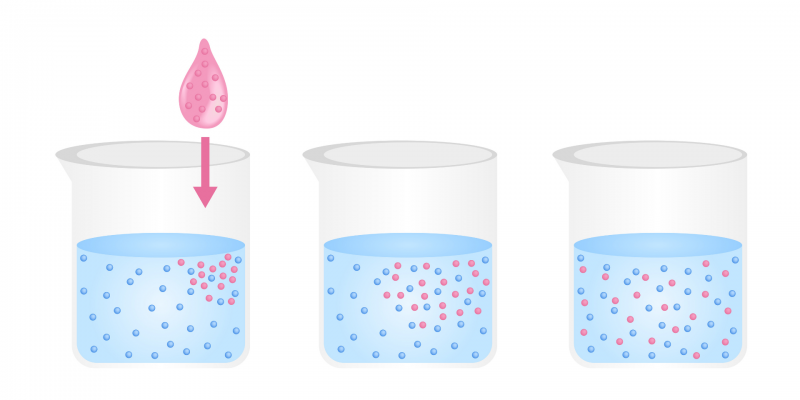
Ejemplos de difusión
- El paso del oxígeno en los alvéolos pulmonares.
- Los impulsos nerviosos, que involucran iones de sodio y potasio a través de la membrana de los axones.
- Si se toma un par difusor formado por dos metales puestos en contacto a través de sus caras, se calientan por encima del punto de fusión y luego se enfrían, se comprobará que la composición ha cambiado: ocurrió difusión de los átomos de níquel hacia el cobre y viceversa.
- El entibiado y el cambio de color de una taza de café cuando se le agrega una buena proporción de leche fría.
- La entrada de glucosa a los glóbulos rojos, provenientes del intestino.
- En un estuario, se produce una difusión del agua del río menos densa que fluye sobre el agua de mar.
- Si se coloca una cucharada de azúcar en un vaso de agua, las moléculas de sacarosa se difunden por el agua.
- La difusión de los gases puede verse cuando una persona perfumada entra en un lugar cerrado, y todos inmediatamente sienten el olor. Lo mismo sucede cuando alguien fuma en un lugar cerrado.
¿Qué es la ósmosis?
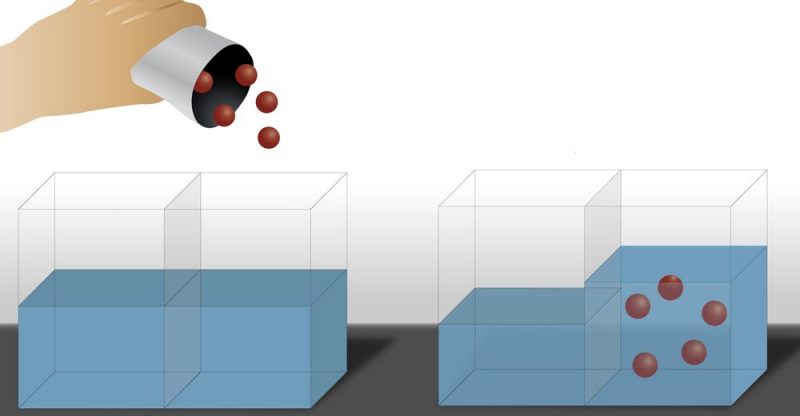
La ósmosis constituye un tipo de difusión, pero con dos características particulares:
- El flujo de partículas ocurre a través de una membrana semipermeable, es decir, una membrana porosa con tamaño de poros a nivel molecular.
- Solo las partículas del solvente pasan a través de la membrana.
De esta forma, se observa que el solvente tiende a atravesar la membrana en el sentido de la disolución cuya concentración es más elevada, lo que acaba produciendo que aumente la cantidad de solvente en la parte más concentrada (en soluto) y disminuya en la parte menos concentrada (en soluto), o sea, el solvente se mueve desde la zona con menos concentración en soluto hacia la zona que tiene más concentración en soluto. Se trata de un proceso que se repite hasta que la concentración (tanto del soluto como del disolvente) de la solución se iguala a ambos lados de la membrana.
También existe la ósmosis inversa, donde en paso del solvente ocurre en sentido contrario que la ósmosis convencional, es decir, el solvente se mueve desde la solución más concentrada en soluto hacia la menos concentrada en soluto. Para lograr que esto ocurra, se aplica una presión a la disolución más concentrada en soluto.
¿Por qué es importante el proceso osmótico?
La solubilidad del soluto en el solvente y la naturaleza de la membrana semipermeable a utilizar son los factores fundamentales que determinan la eficacia del proceso osmótico: uno de los factores que influye en la llamada ‘solubilidad’ son las interacciones entre los componentes de la disolución.
El proceso osmótico es fundamental en los procesos biológicos donde el agua es el solvente, sobre todo en aquellos procesos destinados a mantener el equilibrio hídrico y de electrolitos en los seres vivos, regulando los niveles de agua en la célula o en el cuerpo en general: sin este proceso, no podría haber regulación de líquidos y absorción de nutrientes.
Ejemplos del proceso de ósmosis
- Los seres vivos unicelulares que viven en agua dulce ingresan grandes cantidades de agua.
- La absorción de agua por las raíces en los organismos vegetales, que permite el crecimiento.
- La obtención de agua de las células epiteliales, por parte del intestino grueso.
- Partir una papa, colocando en uno de sus extremos un poco de azúcar con agua, y en el otro un plato con agua. La papa actúa como membrana, y al cabo de un tiempo se verá que la solución que tiene azúcar ahora tiene más líquido.
- La hormona ADH que permite la reabsorción del agua por parte del túbulo colector, en los riñones.
- La eliminación de la orina muy diluida por la que los peces expulsan el máximo líquido con la mínima pérdida de sales.
- La eliminación de agua a través del sudor en las personas.
- Los filtros para purificar el agua trabajan con ósmosis inversa, ya que están hechos con un material que permite el paso del agua, pero no de moléculas más grandes.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)