Índice
En química, cuando hablamos de enlaces simples, dobles y triples nos referimos a tres de las formas conocidas de enlace covalente, es decir, de uniones entre átomos a partir del compartimiento de electrones de sus últimos niveles de energía. También existe el enlace covalente dativo, en cuyo caso los electrones que se comparten son aportados por solo uno de los átomos que forman el enlace.
Los enlaces covalentes tienen lugar cuando dos átomos se aproximan lo suficiente como para solapar parcialmente sus orbitales atómicos (región del espacio donde es probable encontrar un electrón alrededor del núcleo), compensando así las fuerzas de atracción y repulsión simultáneas que surgen a partir de sus cargas eléctricas (los electrones, negativos se repelen entre sí pero las cargas positivas de los núcleos atómicos los atraen) y adquiriendo una estabilidad máxima que les permite constituir una molécula.
Cuando esto sucede, los pares de electrones que orbitan las capas más externas de cada núcleo atómico se desplazan hacia el otro hasta hacer imposible determinar a qué núcleo atómico pertenecían.
Diferencias entre enlace covalente, enlace iónico y enlace metálico
- Los enlaces covalentes
Los enlaces covalentes se forman entre átomos de elementos no metálicos, ya sean del mismo elemento o de distintos elementos. También se forman entre un no metal y el hidrógeno. Para que se forme un enlace de este tipo, la diferencia de electronegatividad entre los átomos del enlace debe ser menor que 1,7.
Si los átomos que conforman un enlace covalente son de distintos no metales, uno de ellos tendrá mayor electronegatividad que el otro. Por eso, los electrones del enlace serán más atraídos por el átomo más electronegativo, quedando una densidad de carga negativa sobre él, mientras que sobre el átomo menos electronegativo quedará una densidad de carga positiva, lo que genera un dipolo (sistema de dos cargas eléctricas de signo contrario que están muy cerca) molecular. En estos casos se forma un enlace covalente polar, que constituye las moléculas polares que pueden atraer a otras moléculas del mismo compuesto.
Por otro lado, si los átomos involucrados en el enlace covalente son del mismo elemento no metálico, no se crearán dipolos, por lo que la diferencia de electronegatividad entre ellos será cero y no habrá atracción entre las moléculas del mismo compuesto. El enlace de este tipo de moléculas se llama “enlace covalente apolar”.
- Los enlaces iónicos
Los enlaces iónicos se forman entre átomos con una elevada diferencia de electronegatividad. Ocurre una transferencia de al menos un electrón del átomo menos electronegativo (formando un catión (+)) al más electronegativo (formando un anión (-)). El enlace finalmente se forma por atracción electrostática entre ambos iones de cargas opuestas.
- Los enlaces metálicos
Los enlaces metálicos se forman entre átomos de elementos metálicos. Los átomos de estos tipos de elementos se encuentran muy unidos entre sí, y los electrones de valencia forman una “nube” a su alrededor.
Tipos de enlace covalente
Dependiendo de la cantidad de pares de electrones compartidos entre los átomos que forman el enlace, los enlaces covalentes serán simples (un par), dobles (dos pares) o triples (tres pares). Cada uno se representa usualmente mediante una, dos o tres líneas entre los símbolos de cada átomo:
- H – H, la molécula de H2 mediante un enlace simple.
- O = O, la molécula de O2 mediante un enlace doble.
- N Ξ N, la molécula de N2 mediante un enlace triple.
La cantidad de enlaces simples, dobles o triples que un átomo podrá formar depende directamente de su valencia, es decir, de la cantidad de electrones que pueda compartir de su capa más externa.
Además, dependiendo del grado de complejidad del enlace, la molécula goza de más o menos movilidad (menos movilidad mientras más complejo el enlace) ya que la distancia entre los átomos es menor y es más difícil romper el enlace, es decir, hay que aplicar más energía para lograr su ruptura.
Ejemplos de enlace covalente simple
- Molécula de hidrógeno (H2)
- Molécula de cloro (Cl2)
- Molécula de fluoruro de hidrógeno (HF)
- Molécula de agua (H2O)
- Molécula de ácido clorhídrico (HCl)

Ejemplos de enlace covalente doble
- Molécula de oxígeno (O2)
- Molécula de dióxido de carbono (CO2)
- Molécula de etileno (C2H4)
- Molécula de propileno (C3H6)

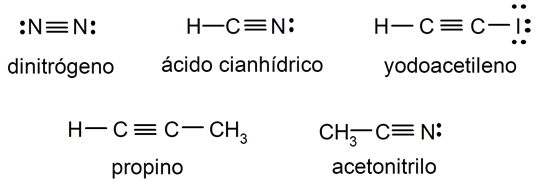
Ejemplos de enlace covalente triple
- Molécula de nitrógeno (N2)
- Molécula de ácido cianhídrico (HCN)
- Molécula de yodoacetileno (HC2I)
- Molécula de propino (C3H4)
- Molécula de acetonitrilo (CH3CN)

Sigue con:
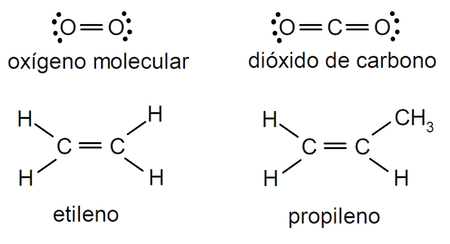
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)