Los ácidos conforman un importante y amplio grupo de compuestos químicos. Por lo general, se define a los ácidos como compuestos que pueden donar uno o más cationes hidrógeno (H+) a otro compuesto, al que se conoce como base. Sin embargo, los ácidos son también definidos según varias teorías:
- Teoría de Arrhenius. Según esta teoría, un ácido se define como una sustancia que puede ceder iones H+ cuando está en disolución Por ejemplo: HCl(ac) y HBr(ac).
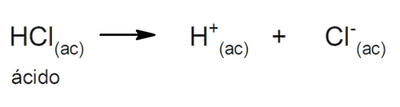
La limitante de esta teoría es que los ácidos están definidos solo en disolución acuosa.
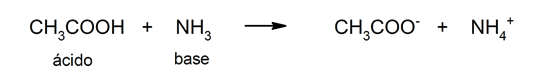
- Teoría de Brönsted y Lowry. Según esta teoría, un ácido también se define como una sustancia que cede un catión H+, pero se lo cede a una base que lo acepta. En esta teoría los ácidos no tienen que estar definidos en disolución acuosa y, además, también se pueden explicar los ácidos orgánicos. Por ejemplo: el ácido acético (CH3COOH).
- Teoría de Lewis. Según esta teoría, un ácido es cualquier especie química, molécula o ion que acepta un par de electrones de otra sustancia. Por ejemplo: el catión H3O+ (H+).

Propiedades de los ácidos
Algunas de las principales características de los ácidos son:
- Se pueden presentar como líquidos o como gases, más raramente como sólidos.
- Liberan cationes hidrógeno y es lo que hace que produzcan soluciones de pH inferior a 7. A los ácidos que pueden liberar más de un protón (utilizando este nombre para los H+) se los llama polipróticos o polifuncionales.
- Se los reconoce por el sabor ácido que los caracteriza, por ejemplo, en las frutas cítricas, que son ricas en ácido cítrico, o en el vinagre, que es una disolución de ácido acético (ambos ácidos orgánicos).
- Existen ácidos orgánicos e inorgánicos, los más fuertes suelen ser los inorgánicos. Muchos ácidos orgánicos cumplen importantes funciones biológicas, como los ácidos nucleicos. Dentro de los inorgánicos existe uno, el ácido clorhídrico, que desempeña un papel importante en el proceso de digestión.
- Son altamente corrosivos.
- Su fuerza está determinada por la tendencia a perder protones.
Tipos de ácidos
Los ácidos pueden ser:
- Ácidos fuertes. Son compuestos con gran tendencia a la disociación, por lo que nada (o casi nada) del ácido protonado queda en la solución. Los ácidos fuertes suelen ser corrosivos, a tal punto que pueden producir quemaduras en la piel. En general son muy buenos conductores de electricidad. Por ejemplo:
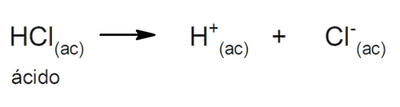
- Ácidos débiles. Son compuestos que se disocian solo parcialmente, de modo que existe un equilibrio entre la forma disociada y la no disociada. Por ejemplo:
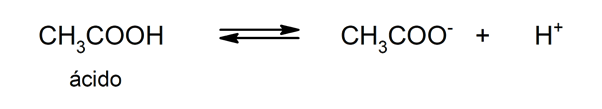
Ejemplos de ácidos y sus usos en la vida cotidiana
Los ácidos tienen muchísimos usos, tanto a escala industrial como en el hogar. Suelen usarse como aditivos y preservantes en alimentos, cosméticos y bebidas, como desinfectantes y como catalizadores (aceleradores de reacciones químicas) en la industria petroquímica o papelera.
Los principales ácidos son:
- Ácido perclórico (HClO4). Es un ácido fuerte y líquido a temperatura ambiente, altamente oxidante y que suele usarse en la actividad industrial. Es empleado en la fabricación de equipos eléctricos y electrónicos, en baterías, en la refinación de metales y en la fabricación de fertilizantes y municiones. Además, en el hogar se usa como limpiador y removedor de óxido. Este ácido también interviene en la producción de perclorato de amonio, que es usado para la propulsión de cohetes, en explosivos y fuegos artificiales.
- Ácido nítrico (HNO3). Es un ácido fuerte e intensamente oxidante, empleado para fabricar ciertos explosivos, fertilizantes nitrogenados y como reactivo de laboratorio (que disuelve casi todos los metales).
- Ácido ascórbico (C6H8O6). Es también llamado vitamina C y es un nutriente necesario para la salud del ser humano. El ácido ascórbico es una sustancia protectora por sus efectos antioxidantes que brinda apoyo al sistema inmunológico, combate infecciones, protege los tejidos, cicatriza heridas, entre otras funciones. Suele encontrarse en la mayoría de las frutas y verduras.
- Ácido clorhídrico (HCl(ac)). Es el único ácido fuerte que sintetiza el cuerpo humano, proceso que ocurre en el estómago durante la degradación de los alimentos en el proceso digestivo. Además, es usado de forma industrial en el procesamiento de alimentos, en la producción de acero y de baterías. El ácido clorhídrico es ingrediente de limpiadores, desinfectantes y de químicos que se usan en la limpieza de piscinas.
- Ácido tartárico (C4H6O6). Es un polvo cristalino blanco que se utiliza en la preparación de bebidas efervescentes, en la industria panadera, vitivinícola y farmacéutica. El cremor tártaro que llevan algunas recetas es ácido tartárico.
- Ácido fluorhídrico (HF(ac)). Es un ácido inorgánico altamente corrosivo. Por su capacidad de atacar el vidrio, se lo usa en el tallado y grabado de cristales. Además, se emplea para obtener compuestos farmacéuticos, como limpiador y para obtener compuestos orgánicos fluorados.
- Ácido sulfúrico (H2SO4). Es un ácido fuerte que tiene muchas aplicaciones en diversas industrias y procesos de síntesis, entre las que se destacan: su uso en la producción de fertilizantes, en la industria petrolera, en la producción de baterías, entre otras.
- Ácido trifluoroacético (C2HF3O2). Es un buen disolvente para muchos compuestos orgánicos, por lo que se usa principalmente en la síntesis orgánica.
- Ácido fosfórico (H3PO4). Es un ácido que está presente en varias bebidas cola, en fertilizantes, detergentes, jabones y comida balanceada.
- Ácido acético (CH3COOH). Es el principal componente del vinagre y debido a su acidez es un conservante de alimentos muy usado. Este ácido se emplea también en la fabricación de acetato de vinilo, como solvente y como componente de limpiadores. Además es usado en el proceso de revelado fotográfico y como material de contraste en el ámbito de la medicina.
- Ácido fluoroantimónico (SbHF6). Es el superácido más fuerte que se conoce y se utiliza para protonar (adherir protones a un átomo o molécula) compuestos orgánicos.
- Ácido crómico (H2CrO4). Es un polvo rojo oscuro que participa del proceso de cromado. Además, se lo utiliza para esmaltar cerámicas, para colorear y limpiar vidrios, en la fabricación de pinturas y en la industria del cuero y de la madera.
- Ácido indolácetico (C10H9NO2). Es el principal representante de las auxinas, fitohormonas que intervienen en el proceso de crecimiento de las plantas. Este proceso incluye la germinación, el crecimiento de raíces y frutos, el crecimiento de hojas, entre otros.
- Ácido desoxirribonucleico (ADN). Es un ácido nucleico que contiene toda la información genética del organismo. El ADN conforma los genes que gobiernan la síntesis de infinidad de proteínas.
- Ácidos tricarboxílicos. Es un grupo de ácidos carboxílicos que tiene tres grupos carboxilos (-COOH). El ácido cítrico (C6H8O7) es un tipo de ácido tricarboxílico que se encuentra en muchas frutas y opera en el organismo como antioxidante.
- Ácido fórmico (CH2O2). Es el más sencillo de los ácidos orgánicos y se emplea en la industria del cuero, en la industria química, para preservar alimento para el ganado, en la industria avícola y en la textil.
- Ácido glucónico (C6H12O7). Es un ácido que tiene sales que son empleadas en procesos de limpieza de objetos de vidrio.
- Ácido láctico (C3H6O3). Es un ácido que se usa como aditivo en la industria alimenticia y para controlar la acidez. También es empleado en la industria cosmética, en productos antiedad.
- Ácido benzoico (C7H6O2). Es un ácido con un olor característico que se utiliza para conservar alimentos que requieren un pH ácido. También se usa como componente en pastas dentífricas, en artículos de perfumería, en la industria tabacalera y para ablandar plásticos.
- Ácido málico (C4H6O5). Es un ácido orgánico muy utilizado en la industria farmacéutica para producir laxantes. Además, se usa en la industria alimenticia, como saborizante o conservante, y en la industria vitivinícola.
- Ácido carbónico (H2CO3). Es un ácido que proviene del dióxido de carbono y está presente en alimentos y bebidas, como las bebidas gaseosas, las cervezas y algunos lácteos. Además, se encuentra en el hielo seco y en las pastillas efervescentes. El ácido carbónico se utiliza en la industria química, en las cámaras de refrigeración y en sistemas de extinción de incendios.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)