Índice
Los fenómenos químicos (o reacciones químicas) son aquellos fenómenos en los que se producen cambios en la materia, y se forman nuevas sustancias llamadas “productos”, y se descomponen otras llamadas “reactivos”. Por ejemplo: pudrición de la madera, combustión del papel, compostaje.
Las reacciones químicas pueden ser espontáneas (reacciones que ocurren sin necesidad de que se les aporte energía ni catalizadores) o no espontáneas (reacciones que necesitan el aporte de energía, catalizadores o alguna intervención externa para que ocurran). Muchas veces, para que ocurra una reacción es necesario que los reactivos tengan una temperatura específica, un pH determinado, un valor de presión establecido, etc.
También puede ser fundamental controlar la velocidad a la que ocurren las reacciones químicas. Los catalizadores son sustancias que se añaden a una reacción química para aumentar su velocidad, mientras que los inhibidores son sustancias que disminuyen la velocidad de las reacciones químicas. Otros factores que afectan la velocidad de una reacción química son la temperatura, la presión, la concentración de los reactivos y la naturaleza propia de la reacción.
Puede servirte:
Tipos de fenómenos químicos
Las reacciones químicas pueden ser:
Reacciones inorgánicas. Intervienen compuestos inorgánicos y se pueden clasificar según:
- El sentido en que ocurre la reacción.
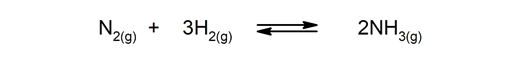
- Reacciones reversibles. Ocurren en ambos sentidos, por lo que los productos pueden descomponerse y formar nuevamente los reactivos.

- Reacciones irreversibles. Solo ocurren en un sentido.

- Reacciones reversibles. Ocurren en ambos sentidos, por lo que los productos pueden descomponerse y formar nuevamente los reactivos.
- El tipo de partícula que reacciona.
- Reacciones ácido-base. Ocurre transferencia de iones H+.

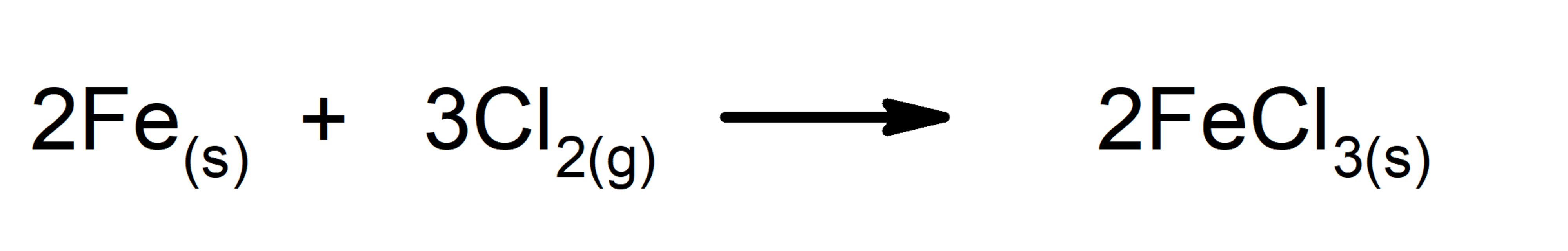
- Reacciones de oxidación-reducción. Uno de los reactivos se oxida (aumenta su número de oxidación), mientras que el otro se reduce (disminuye su número de oxidación). En estas reacciones ocurre transferencia de electrones.

- Reacciones ácido-base. Ocurre transferencia de iones H+.
- La velocidad de reacción.
- Reacciones rápidas. Ocurren en un tiempo muy corto.

- Reacciones lentas. Tardan mucho en completarse.

- Reacciones rápidas. Ocurren en un tiempo muy corto.
- La forma de la energía que emite o absorbe.
- Reacciones exotérmicas. Al ocurrir, liberan calor.

- Reacciones endotérmicas. Al ocurrir, absorben calor.

- Reacciones exoluminosas. Al ocurrir, emiten luz.

- Reacciones endoluminosas. Para ocurrir, necesitan luz.

- Reacciones exotérmicas. Al ocurrir, liberan calor.
- El tipo de transformación.
- Reacciones de síntesis o adición. Dos sustancias se combinan para formar una sustancia nueva.

- Reacciones de descomposición. Una o más sustancias se descomponen en sus constituyentes más simples.

- Reacciones de desplazamiento o sustitución. Un elemento o compuesto sustituye a otro en un compuesto, liberándolo.

- Reacciones de doble sustitución. Dos compuestos intercambian a la vez elementos o compuestos.

- Reacciones de síntesis o adición. Dos sustancias se combinan para formar una sustancia nueva.
Reacciones orgánicas. Son reacciones en las que intervienen compuestos orgánicos. Tienen muchas clasificaciones en base al tipo de compuesto orgánico que reacciona y al tipo de reacción que experimenta. Algunos ejemplos son:
- Halogenación de alcanos. Se sustituye un hidrógeno de un alcano por un halógeno.

- Combustión de alcanos. Reacciona un alcano con el oxígeno para generar dióxido de carbono y agua, en caso de que la combustión sea completa.

- Halogenación de alquenos. Se sustituye por halógenos uno o los dos hidrógenos de los carbonos que están involucrados en el doble enlace.

- Hidrogenación de alquenos. Se agregan hidrógenos a los carbonos involucrados en el doble enlace para formar el alcano correspondiente.

Importancia de los fenómenos químicos
Muchos fenómenos químicos sostienen la vida de los seres vivos, como la digestión en los seres humanos y animales, la fotosíntesis en las plantas y la respiración en ambos.
Otro proceso químico muy importante, sobre todo en la vida de los microorganismos, es la fermentación, que se suele aprovechar en la fabricación de alimentos como quesos, yogures, vinos y cervezas.
Todo el crecimiento y el desarrollo de un ser vivo involucra reacciones químicas que se producen en él, a veces estimuladas por determinadas condiciones ambientales.
Ejemplos de fenómenos químicos
A nuestro alrededor existen numerosos casos de fenómenos químicos o de procesos que los incluyen:
- Pudrición de la madera
- Combustión de papel
- Resistencia a antibióticos de bacterias
- Leche que se pone agria
- Desinfección de una herida con alcohol
- Uso de sal de frutas para combatir la acidez estomacal
- Combustión de una vela
- Coagulación de la sangre
- Fatiga muscular tras el ejercicio intenso
- Muerte de insectos por insecticidas
- Obtención de queso roquefort
- Obtención de sidra
- Obtención de yogur
- Compostaje
- Ensilado
- Obtención de bioetanol a partir de melaza
- Latas de conserva hinchadas
- Huevo podrido
- Oxidación de una reja
- Obtención de biodiesel a partir de aceite de palma
Los fenómenos químicos en la industria
Ciertos fenómenos químicos también son clave en la industria. Por empezar, la combustión de hidrocarburos (como la nafta, el gasoil o el queroseno) produce energía para hacer funcionar las maquinarias que manejan un sinnúmero de procesos industriales.
Por otro lado, la industria siderúrgica, papelera, de plásticos, de materiales de construcción, de pinturas, de fármacos, de productos para el agro, etc., tienen como base diversos fenómenos químicos como la galvanización, la electrólisis y muchos otros más.
La generación de nuevas fuentes de energía (como el biodiesel y el bioetanol) también se basa en este tipo de fenómenos.
La transformación de la energía
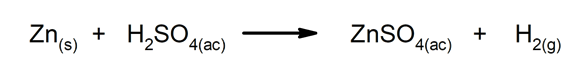
En los fenómenos químicos es común que haya transformación de la energía. Por ejemplo, cuando la energía química contenida en los enlaces de cierta molécula se transforma en energía eléctrica o se libera como calor (esto ocurre en los fenómenos exotérmicos, como cuando se mezcla ácido clorhídrico con zinc), existe una transformación de energía. Lo mismo ocurre cuando la energía luminosa es captada y transformada en energía química.
Algunos procesos químicos necesitan calor para llevarse a cabo y se los denomina “endotérmicos”. Otros requieren la presencia de catalizadores o cofactores.
Sigue con:


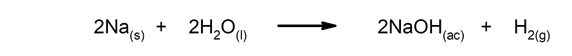
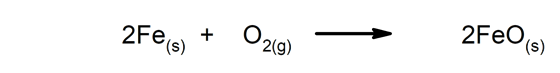
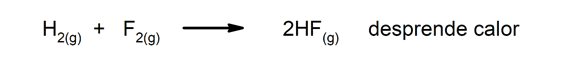



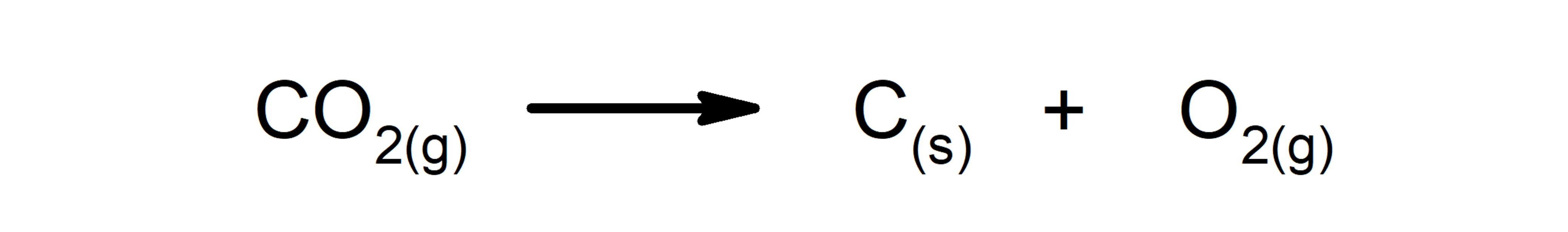

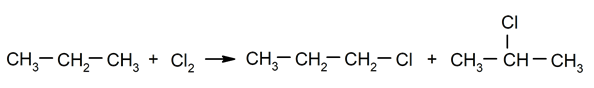
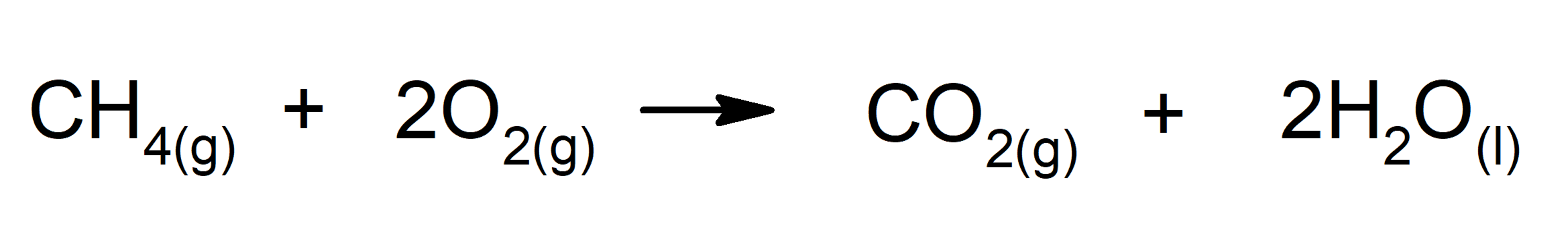
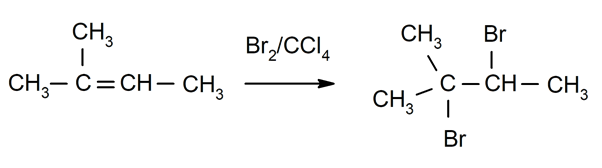
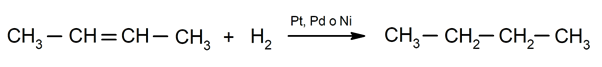
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)