La química es la ciencia que estudia la composición y las transformaciones que le pueden ocurrir a la materia, en cualquiera de sus formas. Una de las áreas más importantes de estudio en la química es la de los gases.
El concepto de gas fue establecido por el químico belga Jan van Helmont. Para explicar el comportamiento de los gases, se desarrollaron distintas ecuaciones matemáticas empleando herramientas estadísticas. Sin embargo, fue necesario simplificar y modificar estas ecuaciones porque no funcionaban para todos los tipos de gases, por lo que se definieron distintos modelos de gases (gas ideal y gas real, entre otras aproximaciones intermedias). Por ejemplo: nitrógeno, helio, metano.
En este sentido, se establecieron tres leyes para relacionar de manera general el volumen, la temperatura y la presión de los gases:
- Ley de Boyle-Mariotte. Establece que la presión de un gas es inversamente proporcional a su volumen a temperatura constante.
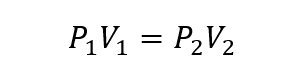
- Ley de Charles. Establece que el volumen que ocupa una cantidad de gas es directamente proporcional a su temperatura a una determinada presión.
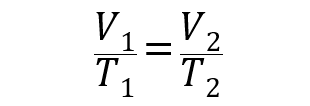
- Ley de Gay-Lussac. Establece que la presión de un gas es directamente proporcional a su temperatura a volumen constante.
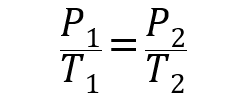
Donde P1, V1 y T1 son la presión, volumen y temperatura iniciales del gas respectivamente, y P2, V2 y T2 son las finales.
Así, relacionando las tres leyes se obtiene la Ley General de los Gases,
PV/T=C donde C es una constante que depende de la cantidad de gas.
Ejemplos de gas ideal
El gas ideal es un modelo teórico que representa a un gas que realmente no existe. Es una herramienta para facilitar una gran cantidad de cálculos matemáticos, pues simplifica mucho el complejo comportamiento de un gas. Este gas se considera formado por partículas que no se atraen ni se repelen entre sí y cuyos choques son absolutamente elásticos. Es un modelo que falla si el gas está sometido a altas presiones y bajas temperaturas.
La ecuación general de los gases ideales resulta de la combinación de las leyes de Boyle-Mariotte, Charles y Gay Lussac con la ley de Avogadro. La ley de Avogadro plantea que si distintas sustancias gaseosas están contenidas en volúmenes iguales y sometidas a la misma presión y temperatura, entonces tienen el mismo número de partículas. Así, la ecuación de estado del gas ideal es:
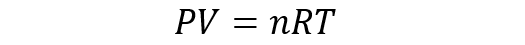
Donde n es el número de moles del gas y R es la constante de los gases igual a 8.314 J/Kmol.
No es posible elaborar una lista concreta de gases ideales ya que se trata de un gas hipotético. e puede enumerar un conjunto de gases (entre ellos los gases nobles) cuyo tratamiento puede ser aproximado al de los gases ideales, porque las características son similares, siempre y cuando las condiciones de presión y temperatura sean las normales.
- Nitrógeno (N2)
- Oxígeno (O2)
- Hidrógeno (H2)
- Dióxido de carbono (CO2)
- Helio (He)
- Neón (Ne)
- Argón (Ar)
- Kriptón (Kr)
- Xenón (Xe)
- Radón (Rn)
Ejemplos de gases reales
Los gases reales son aquellos que tienen un comportamiento termodinámico y por eso no siguen la misma ecuación de estado que los gases ideales. En alta presión y baja temperatura, los gases inevitablemente deben considerarse como reales, pues en ese caso aumentan las interacciones entre sus partículas.
La diferencia sustancial entre el gas ideal y el gas real es que este último no puede ser comprimido en forma indefinida sino que su capacidad de compresión es relativa a los niveles de presión y temperatura.
Se han desarrollado distintas ecuaciones para explicar el comportamiento de los gases reales. Una de las más importantes es la aportada por Van der Waals en 1873, la que debe ser aplicada en condiciones de alta presión. La ecuación de Van der Waals se representa como:
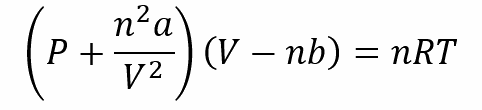
Donde a y b son constantes referidas a la naturaleza de cada gas.
La siguiente lista expone algunos ejemplos de gases reales, aunque también se pueden agregar los que ya han sido enumerados como gases ideales, pero esta vez en un contexto de alta presión y/o baja temperatura.
- Amoníaco (NH3)
- Metano (CH4)
- Etano (CH3CH3)
- Eteno (CH2CH2)
- Propano (CH3CH2CH3)
- Butano (CH3CH2CH2CH3)
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)