Se le llama reacción química al proceso mediante el cual una o más sustancias químicas (denominadas “reactivos”) se transforman y dan origen a otras (designadas “productos”). Así, para que los reactivos generen los productos mediante una reacción química, debe ocurrir una reorganización de átomos y moléculas en la que se produce un intercambio de energía. Por ejemplo: combustión, oxidación, reacciones ácido-base.
Los compuestos químicos tienen energía química en los enlaces entre los átomos que los componen. Las reacciones químicas se suelen expresar a través de ecuaciones, donde a la izquierda se indican los reactivos y a la derecha los productos, vinculando ambas partes con una flecha hacia la derecha si la reacción es irreversible o una flecha de ida y vuelta si se trata de una reacción reversible.
Cuando se indican las cantidades o proporciones en las que reaccionan los reactivos y se obtienen los productos, se habla de reacciones estequiométricas.
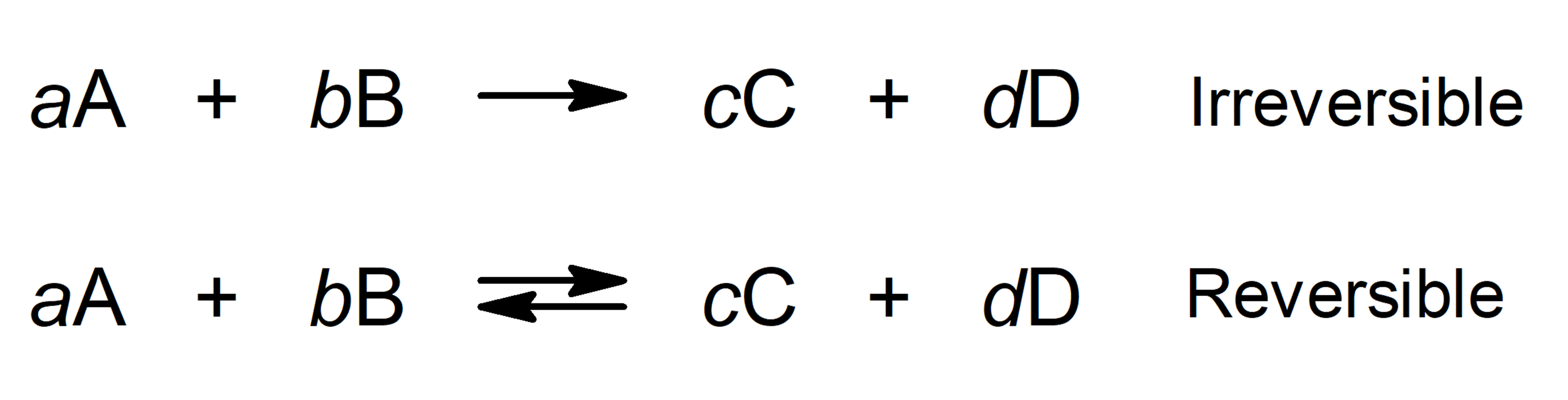
Donde:
- A y B son los reactivos.
- C y D son los productos.
- a, b, c, d son los coeficientes estequiométricos (cantidad de moléculas o átomos de un determinado tipo que participa en una ecuación química).
Las reacciones químicas se pueden clasificar según el tipo de energía que liberan o absorben. En este sentido, pueden ser exotérmicas o endotérmicas (si liberan o absorben calor), exoluminosas o endoluminosas (si liberan o absorben luz), exoeléctricas o endoeléctricas (si producen o necesitan electricidad).
Las leyes de las reacciones químicas
En las reacciones químicas se cumplen las leyes. La más importante es la ley de conservación de la masa o ley de Lavoisier, formulada por este químico en 1774, que postula que en toda reacción química la masa de los reactivos es igual a la masa de los productos.
Fue Dalton quien completó la explicación a esta ley algunos años después, al indicar que en una reacción química el número de átomos no varía al comparar los reactivos con los productos, solo cambia su organización, por lo que la masa de se conserva.
Otro parámetro importante en las reacciones químicas es su velocidad de reacción ya que no todas tardan el mismo tiempo en producirse. La velocidad de reacción se define como la cantidad de producto que aparece por unidad de tiempo o la cantidad de reactivo que desaparece por unidad de tiempo.
Aunque cada reacción tiene diferente velocidad, ciertos factores pueden hacer que tienda a aumentar o a disminuir: la superficie de contacto entre las partículas que reaccionan y la temperatura son algunos de ellos.
Los catalizadores son sustancias que aumentan la velocidad de una reacción, sin modificar su estructura. A menudo cumplen este papel algunos metales.
Ejemplos de reacciones químicas
Continuamente se producen reacciones químicas en la naturaleza, en el cuerpo humano, en las fábricas, en las plantas de tratamiento de efluentes, etc. Algunos ejemplos son:
- Combustión

- Sustitución

- Adición

- Eliminación

- Oxidación

- Reducción

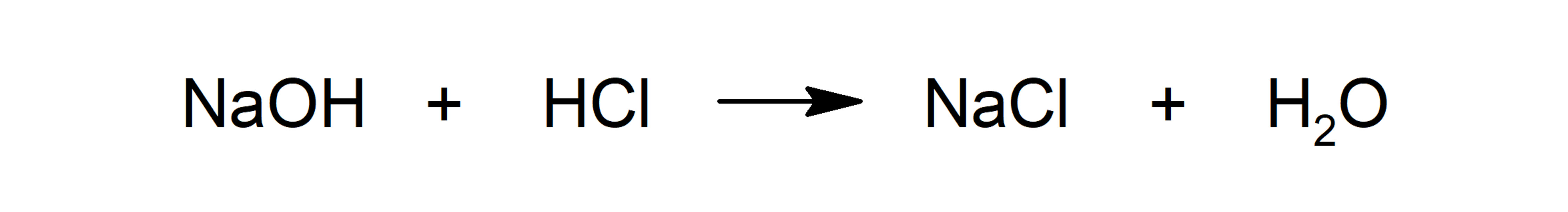
- Reacciones ácido-base

- Oxigenación

- Transaminación

- Cloración

- Carbonilación

- Nitrosilación. Es una reacción donde se le enlaza un grupo nitrosilo a una proteína, luego de que haya sido sintetizada por los ribosomas.

- Peroxidación

- Fotolisis del agua

- Sulfatación

- Carbonatación

- Ozonización. Es una reacción alternativa a la cloración para descontaminar el agua.
- Esterificación

- Hidrogenación de alquenos

- Acetilación

Sigue con:
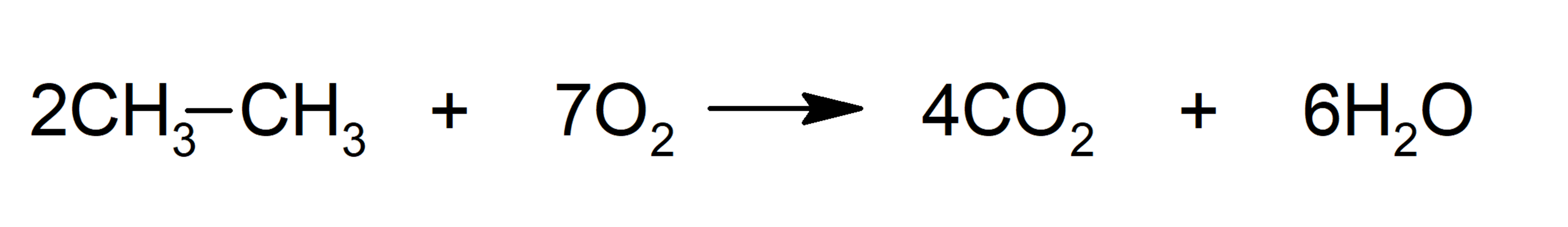
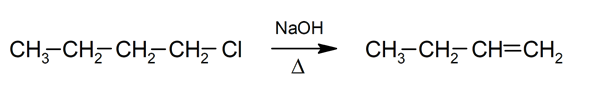
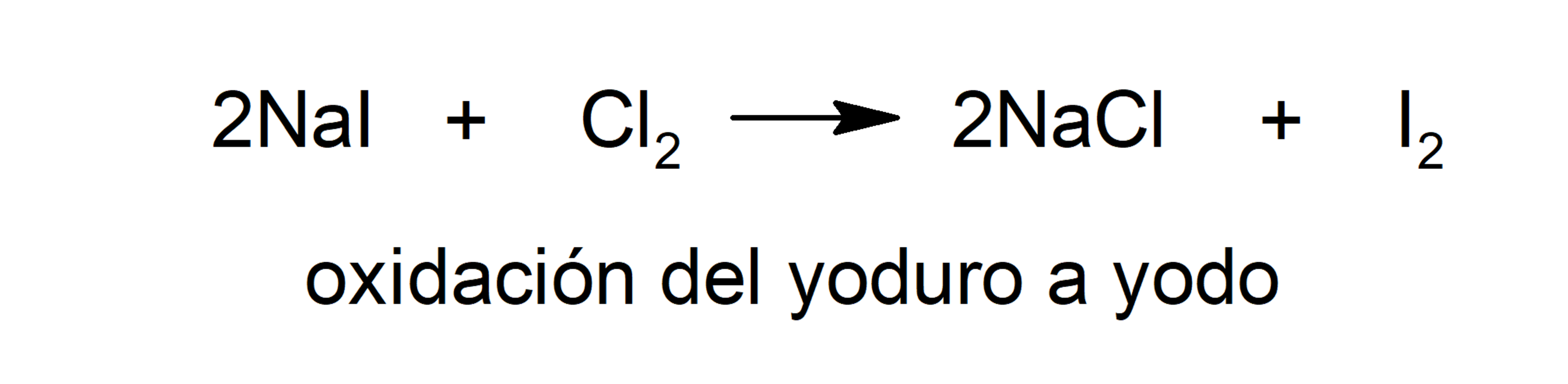



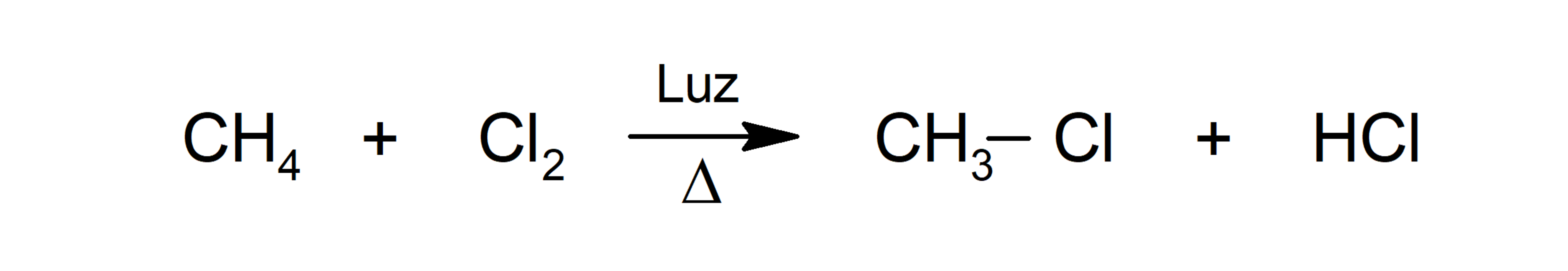



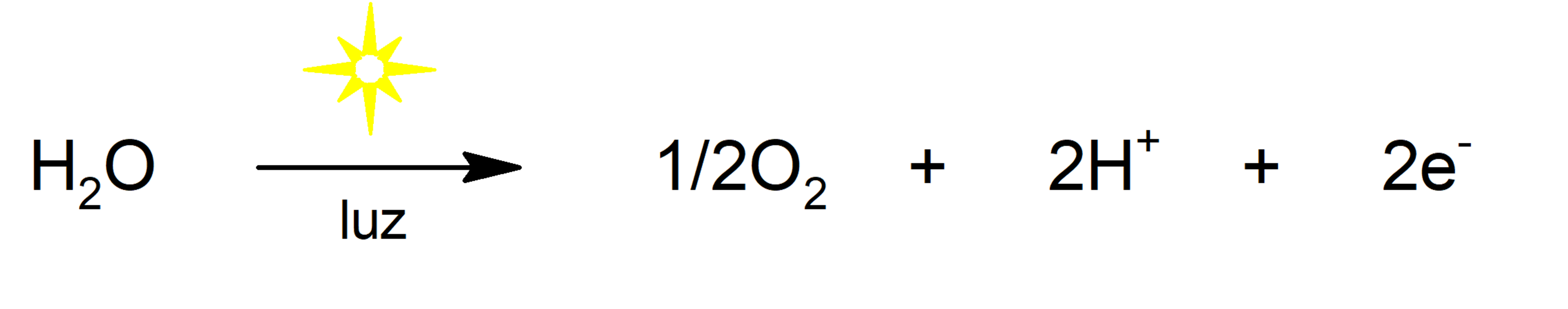
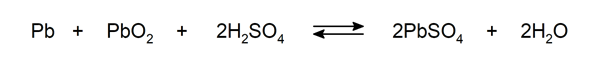
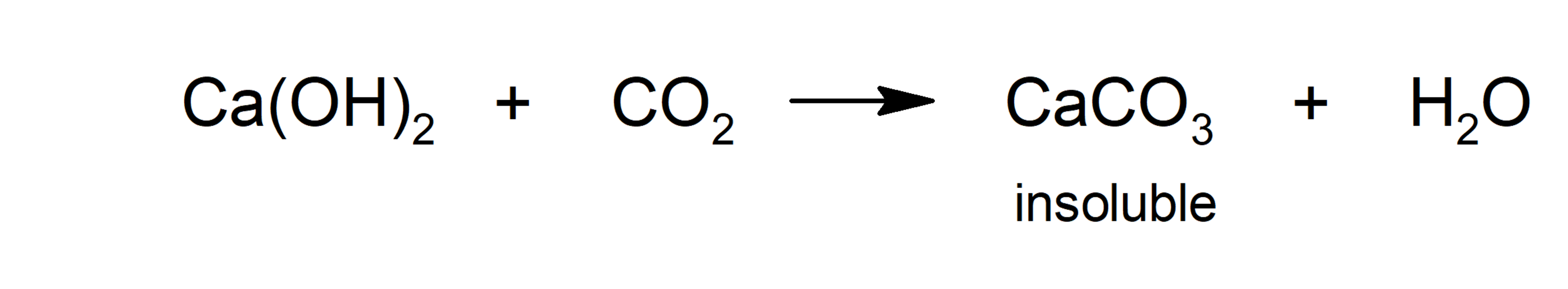
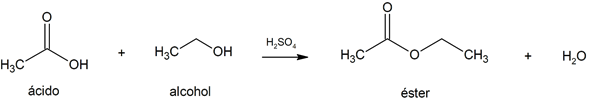
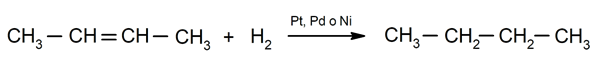
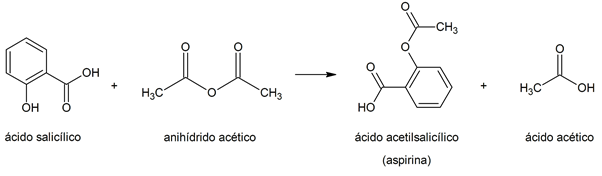
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)