En la química inorgánica se llama sales a compuestos que se obtienen cuando a un ácido se le sustituyen sus átomos de hidrógeno por cationes metálicos (aunque a veces por cationes no metálicos, por ejemplo, el catión amonio, NH4+). En el caso específico de las sales ácidas, los hidrógenos del ácido son sustituidos parcialmente, es decir, queda al menos un hidrógeno sin sustituir formando parte de la sal. En eso se distinguen de las sales neutras, donde los hidrógenos del ácido son sustituidos totalmente.
Las sales se forman usualmente a través de la reacción entre un ácido y un hidróxido (base). En estas reacciones, normalmente la base pierde sus grupos hidroxilo (-OH) y el ácido los átomos de hidrógeno (H), formando una sal neutra; pero si el ácido en cuestión conserva por lo menos uno de sus átomos de hidrógeno, alterando la carga eléctrica de la reacción, obtendremos una sal ácida o sal hidrogenada.
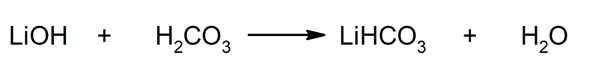
Así, por ejemplo, se obtiene bicarbonato de litio y agua a partir de la reacción entre el hidróxido de litio y el ácido carbónico:
Nomenclatura de las sales ácidas
Las sales ácidas se pueden nombrar según los tres tipos de nomenclatura más comunes:
- Nomenclatura tradicional. Se nombra la sal como si fuese neutra, pero se pone la palabra ‘ácido’ antes del nombre del metal o el prefijo (bi-) antes del nombre de la sal. Por ejemplo: carbonato ácido de litio o bicarbonato de litio (LiHCO3).
- Nomenclatura stock. Se nombra la sal como si fuese neutra pero anteponiendo a su nombre la palabra ‘hidrógeno’. Por ejemplo: hidrógeno carbonato de litio (LiHCO3).
- Nomenclatura sistemática. Se nombra la sal poniendo la palabra ‘hidrógeno’ seguido del prefijo que indique la cantidad de oxígenos (di-, tri-, tetra-), luego se pone la palabra ‘oxo’ seguido del nombre del anión de la sal como si fuese neutra indicando en números romanos y entre paréntesis el número de oxidación del no metal que compone su anión, finalmente se pone ‘de nombre del metal’. Por ejemplo: hidrógeno trioxocarbonato (IV) de litio (LiHCO3).
Ejemplos de sales ácidas
- Bicarbonato de sodio (NaHCO3). También llamado hidrogenocarbonato (IV) de sodio, es un sólido cristalino de color blanco, soluble en agua, que puede encontrarse en la naturaleza en estado mineral o puede producirse en el laboratorio. Es una de las sales ácidas más conocidas y se emplea abundantemente en repostería, farmacología o elaboración de yogures.
- Bicarbonato de litio (LiHCO3). Esta sal ácida ha sido empleada como agente capturante del CO2 en situaciones en que dicho gas es indeseable, como en las misiones espaciales norteamericanas “Apolo”.
- Dihidrógeno fosfato de potasio (KH2PO4). Es un sólido cristalino, inodoro, soluble en agua, ampliamente usado en diversas industrias como levadura de alimentos, agente quelante, fortificador nutricional y ayudante en los procesos de fermentación.
- Bisulfato sódico (NaHSO4). Es una sal ácida formada por la neutralización del ácido sulfúrico. Es muy utilizado industrialmente en el refinado de metales y productos de limpieza. Aunque es altamente tóxico para algunos equinodermos, se emplea como aditivo en la comida de las mascotas y en la manufactura de joyas.
- Hidrogenosulfuro de sodio (NaHS). Es un compuesto peligroso de manipulación delicada, dado que es altamente corrosivo y tóxico. Puede provocar quemaduras graves en la piel y lesiones oculares graves, ya que además es combustible.
- Hidrogenofosfato de calcio (CaHPO4). Es empleado como suplemento dietético en cereales para ganado. Es un sólido insoluble al agua pero capaz de cristalizar al ser hidratado consumiendo dos moléculas de agua.
- Hidrogenocarbonato de amonio ([NH4]HCO3). También conocido como “bicarbonato de amonio”, es empleado en la industria alimenticia como levadura química, aunque tiene la desventaja de atrapar el amoníaco e imprimir mal sabor a las comidas si se usa en exceso. También se usa en extintores de incendios, elaboración de pigmentos y para expandir el caucho.
- Bicarbonato de bario (Ba[HCO3]2). Es una sal ácida que al ser calentada puede revertir su reacción de producción y que es altamente inestable, excepto en solución. Se utiliza mucho en la industria de la cerámica.
- Bisulfito sódico (NaHSO3). Esta sal es sumamente inestable y en presencia de oxígeno deriva en sulfato de sodio (Na2SO4), por lo que se utiliza en la industria alimenticia como preservante y desecante de alimentos. Es un agente reductor extremo y de uso común por el hombre, usado también en la fijación de los colores.
- Citrato de calcio (Ca3[C6H5O7]2). Conocida comúnmente como sal amarga, se emplea como conservante de alimentos y como complemento nutricional cuando está ligado al aminoácido lisina. Es un polvo cristalino, inodoro, blanco.
- Fosfato monocálcico (Ca[H2PO4]2). Es un sólido incoloro que se obtiene de la reacción de hidróxido de calcio y ácido fosfórico, muy empleado como agente leudante o como fertilizante en labores del agro.
- Fosfato dicálcico (CaHPO4). Conocido también como monohidrógeno fosfato de calcio, posee tres distintas formas cristalinas que se emplean como aditivo en las comidas y está presente en los dentríficos. Además, se forma naturalmente en los cálculos renales y en la llamada “piedra renal”.
- Fosfato de monomagnesio (MgH4P2O8). Es una sal blanca, cristalina e inodora, parcialmente soluble en agua. Se utiliza en la preservación de alimentos, como acidulante, como corrector de la acidez o agente en el tratamiento de las harinas.
- Diacetato de sodio (NaH[C2H3O2]2). Esta sal se emplea como saborizante y agente conservador de las comidas, que impide o retrasa la aparición de hongos y micobacterias, tanto en productos envasados al vacío como productos cárnicos y en la industria de las harinas.
- Bicarbonato de calcio (Ca[HCO3]2). Es una sal hidrogenada que se origina a partir del carbonato de calcio, presente en minerales como la caliza, el mármol y otros. Esta reacción implica la presencia de agua y CO2, por lo que puede darse espontáneamente en grutas y cuevas ricas en calcio.
- Fluoruro ácido de rubidio (RbHF). Esta sal se obtiene de la reacción del ácido fluorhídrico (hidrógeno y flúor) y rubidio, un metal alcalino. El resultado es un compuesto tóxico y corrosivo que debe manejarse con precaución.
- Fosfato monoamónico ([NH4]H2PO4). Es una sal soluble al agua producida por la reacción del amoníaco y el ácido fosfórico. Suele utilizarse como fertilizante ya que otorga al suelo los nutrientes de nitrógeno y fósforo necesarios para el crecimiento vegetal. También forma parte del polvo ABC en los extintores de incendios.
- Ortoborato hidrógeno de zinc (Zn[HBO3]). Es una sal empleada como antiséptica y como aditivo en la elaboración de las cerámicas.
- Fosfato monosódico (NaH2PO4). Se utiliza más que nada en laboratorios, como “buffer” o solución amortiguadora, que previene cambios bruscos en el pH de una solución.
- Hidrogenoftalato de potasio (KHP). También llamado “ftalato ácido de potasio”, es una sal sólida y estable en el aire ordinario, por lo que se utiliza a menudo como patrón primario en mediciones de pH. También es útil como agente tampón en reacciones químicas.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)