El pH es una sigla que significa potencial de hidrógeno, y funciona como una medida de la acidez o de la alcalinidad de una disolución, ya que indica la concentración de iones de hidrógeno o hidronio ([H3O+] o [H+]) presentes en una disolución.
Está demostrado que hay una correlación completa entre la concentración de los iones de hidrógeno y el nivel de acidez de una sustancia: los ácidos fuertes tienen altas concentraciones de iones de hidrógeno, mientras que los débiles tienen concentraciones bajas.
El bioquímico Sørensen propuso en 1909 que matemáticamente el pH se define como el negativo del logaritmo decimal de la actividad (concentración efectiva) de iones hidrógeno en una disolución. Si la disolución es diluida, se puede emplear la concentración molar en lugar de la actividad.
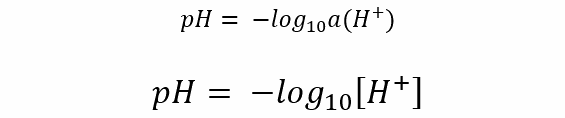
Donde a(H+) y [H+] son la actividad y la concentración molar de iones de hidrógeno respectivamente.
La escala pH se establece entre el número 0 y 14: el 0 es el extremo de ácido, mientras que el 14 es el extremo de alcalino. El número 7, el intermedio, es el que se conoce como pH neutro.
¿Cómo se mide el pH?

Para la medición del pH, es frecuente que se utilice un producto químico llamado indicador de pH. Uno de los indicadores más conocidos es el Papel de Tornasol, un papel con sustancias adheridas que son sensibles a los cambios de pH y hacen que el papel cambie su color dependiendo de la acidez de la solución en la que se sumerja.
Las sustancias más ácidas harán que el papel se vuelva rosa, mientras que las más básicas harán que se ponga azul. Algunos de los papeles de este tipo tienen señalizaciones de los niveles de colores que adquieren según el pH, para que quien lo utiliza pueda decodificar el nivel de potencial de hidrógeno sencillamente con el color.
Sin embargo, el papel de Tornasol no es completamente preciso, y en los casos donde no es lo suficiente preciso, se utiliza un aparato conocido como pH-metro. Este es un instrumento de medición constituido generalmente por un electrodo de plata/cloruro de plata (Ag/AgCl) y un electrodo de vidrio sensible a los iones de hidrógeno. Así, el pH se puede medir por la variación de potencial entre ambos electrodos cuando se sumergen en una disolución.
Ejemplos del pH de ciertas sustancias

| Jugo de limón (pH 2) | Jugo de naranja (pH 4) |
| Jugo gástrico (pH 1) | Cerveza (pH 5) |
| Detergente (pH 10,5) | Amoníaco (pH 12) |
| Agua jabonosa (pH 9) | Lejía (pH 13) |
| Agua de mar (pH 8) | Refresco de cola (pH 3) |
| Agua de cal (pH 11) | Ácido clorhídrico (pH 0) |
| Leche de magnesia (pH 10) | Batería (pH 1) |
| Piel humana (pH 5,5) | Hidróxido de sodio (pH 14) |
| Leche (pH 6) | Agua pura (pH 7) |
| Vinagre (pH 3) | Sangre (pH 7) |
¿Cómo mantener el pH constante?
En ocasiones, el procedimiento de laboratorio necesita preparar y guardar una solución con pH constante. La preservación de dicha solución es más difícil que su preparación, pues si entra en contacto con el aire absorberá dióxido de carbono y se volverá más ácida, al tiempo que si se guarda en un recipiente de vidrio se volverá más alcalina por efecto de las impurezas desprendidas del vidrio.
Las soluciones buffer son aquellas capaces de mantener su pH estable en un rango determinado de pH frente a la adición de cantidades relativamente pequeñas de ácidos o bases fuertes.
Las soluciones de este tipo se preparan con un ácido débil, por ejemplo, ácido acético (CH3COOH), y una sal del mismo ácido, por ejemplo, acetato de sodio (C2H3O2Na), o empleando una base débil, por ejemplo, amoníaco (NH3), y una sal de la misma base, por ejemplo, cloruro de amonio (NH4Cl). Incluso en los organismos vivos las células deben mantener un pH casi constante, para la acción enzimática y metabólica.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)