Las disoluciones son un tipo de mezcla formada por componentes que no reaccionan químicamente entre sí, pero que pueden modificar sus propiedades físicas cuando pasan a formar parte de la disolución. Por ejemplo: humo, amalgama, café con leche.
Para que una mezcla sea una disolución es necesario que sea homogénea y uniforme, es decir, que los componentes mezclados no se puedan distinguir a simple vista y que, además, la proporción entre el soluto (sustancia que aparece en menor cantidad) y el solvente (sustancia que aparece en mayor cantidad) se mantenga aproximadamente invariable en cualquier volumen que se tome de la disolución.
La proporción del soluto en la disolución o en el solvente es lo que se denomina “concentración” y habitualmente una disolución se puede preparar utilizando varias concentraciones de soluto.
Tipos de disoluciones
Las disoluciones se pueden clasificar de acuerdo al estado de agregación que tengan. Es importante mencionar que se pueden formar disoluciones entre sustancias que antes de estar mezcladas estén en cualquiera de los distintos estados de agregación de la materia: sólido, gaseoso o líquido.
Existen disoluciones en prácticamente todos los estados de agregación. Generalmente, el estado de agregación de la disolución queda determinado por el estado de agregación del solvente.
Los tipos de disoluciones son:
- Disolución de gases en gases (gaseosa). Por ejemplo: el aire que respiramos.
- Disolución de sólidos en gases (gaseosa). Por ejemplo: el polvo disuelto en el aire.
- Disolución de líquidos en gases (gaseosa). Por ejemplo: el vapor de agua en el aire.
- Disolución de sólidos en líquidos (líquida). Por ejemplo: la sal de mesa (NaCl) disuelta en agua.
- Disolución de líquidos en líquidos (líquida). Por ejemplo: el etanol (CH3CH2OH) disuelto en agua.
- Disolución de gases en líquidos (líquida). Por ejemplo: el oxígeno (O2) disuelto en agua.
- Disolución de sólidos en sólidos (sólida). Por ejemplo: las aleaciones, como el bronce (aleación de cobre y estaño).
- Disolución de gases en sólidos (sólida). Por ejemplo: el gas hidrógeno disuelto en paladio.
- Disolución de líquidos en sólidos (sólida). Por ejemplo: las amalgamas, que son la disolución de mercurio en otros metales sólidos.
Además, es habitual que la presencia de moléculas de soluto dentro de un solvente altere las propiedades del mismo solvente. Por ejemplo, el punto de fusión y de ebullición de dos compuestos se modifica cuando estos compuestos se mezclan y también se pueden modificar sus densidades y colores.
Ley de Raoult
El científico francés François Marie Raoult estudió el comportamiento de los componentes en las disoluciones y propuso la Ley de Raoult. Esta ley establece que la presión de vapor parcial de cada componente en la mezcla de vapores, que rodea a una disolución ideal de líquidos, es igual a la presión parcial de cada componente puro por su fracción molar en la disolución.
Se considera disolución ideal a aquella disolución en la que las especies químicas son muy similares, por lo que no se considera variación en la energía de las interacciones entre ellas. La ecuación fundamental de la Ley de Raoult es:
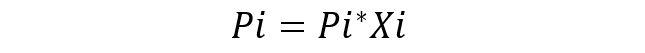
Donde:
- Pi es la presión parcial del componente i en la mezcla gaseosa que rodea a la disolución.
- Pi* es la presión del componente i.
- Xi es la fracción molar del componente i en la disolución.
Ejemplos de disoluciones en la vida cotidiana
Las disoluciones son mezclas que están presentes en varios ámbitos, tanto en la naturaleza como en el hogar y en las industrias. Algunas de las más comunes son:
- Aire (gas en gas). Es una disolución formada por gases, entre los que se destacan el nitrógeno y el oxígeno, que está presente en la atmósfera.
- Humo (sólido en gas). Es una disolución en la que el aire actúa como solvente y que se genera tras una combustión.
- Aleaciones entre metales (sólido en sólido). Son mezclas que se dan entre metales, por ejemplo, el duraluminio es una aleación compuesta por aluminio, cobre, manganeso, magnesio y silicio.
- Polvo atmosférico del aire (sólido en gas). Es una disolución formada por la presencia de sólidos (partículas de polvo) en el gas.
- Acero (sólido en sólido). Es una aleación entre hierro y carbono, con una proporción mucho mayor del primer elemento, que se usa en la fabricación de máquinas y herramientas.
- Bebida carbonatada (gas en líquido). Es comúnmente llamada “gaseosa” y es una disolución de gases (como el ácido carbónico) dentro de un líquido (agua).
- Amalgama (líquido en sólido). Es una aleación de mercurio que está disuelto en ciertos metales como el oro o la plata y que suele usarse en la odontología.
- Petróleo refinado (líquido en líquido). Es una disolución formada tras la combinación de elementos (el mayoritario es el carbono) y que se usa como combustible.
- Butano en aire (gas en gas). Es la disolución que se da entre el alcano butano y el aire. El butano es un compuesto químico gaseoso que se puede almacenar en tubos y es usado como combustible.
- Oxígeno en el agua del océano (gas en líquido). Es la disolución que se da entre el agua y el oxígeno y que permite el desarrollo de la vida acuática.
- Bebida alcohólica (líquido en líquido). Es una disolución de etanol y jugos de frutas.
- Café con leche (líquido en líquido). Es una disolución en la que el café disuelto en agua recibe leche lo que genera una transformación de su color y sabor.
- Smog (gases en gases). Es una disolución que se da a partir de la introducción de gases que no son propios de la atmósfera, lo que induce a una transformación del aire.
- Sal en agua (sólido en líquido). Es una disolución líquida y homogénea que se obtiene cuando la sal se disuelve en agua.
- Sangre (líquido en líquido). Es la disolución que se da entre el componente mayoritario de la sangre (el plasma) y otros elementos como los glóbulos rojos.
- Amoníaco en agua (líquido en líquido). Es una disolución de amoníaco y agua (que también puede hacerse de un gas a un líquido) que es usada en muchos insumos de limpieza.
- Aire con rasgos de humedad (líquido en gas). Es la disolución que se da cuando el vapor de agua está presente en el aire debido al aumento de temperatura.
- Jugo en polvo (sólido en líquido). Es una solución que se obtiene cuando el polvo de jugo instantáneo se disuelve en el agua y se genera un líquido de color.
- Hidrógeno en paladio (gas en sólido). Es la disolución que se obtiene cuando el hidrógeno se disuelve en algunos metales, como el paladio.
- Virus que se transportan por el aire (sólido en gas). Es una disolución que ocurre cuando unidades muy pequeñas de un sólido se transportan por un gas.
- Mercurio en plata (líquido en sólido). Es una de las llamadas “amalgamas”.
- Té (sólido en líquido). Es una disolución que se obtiene cuando un sólido en dimensiones muy pequeñas (los granitos del sobre de té) se disuelven en el agua.
- Agua regia (líquido en líquido). Es una composición de ácidos que permite disolver distintos metales, como el oro.
- Bronce (sólido en sólido). Es la aleación entre el cobre y el estaño que se utiliza para fabricar utensilios, joyas, en industrias como la minería y en sectores del transporte ferroviario y naval.
- Limonada (líquido en líquido). Es una solución formada por jugo de limón que se disuelve en agua.
- Agua oxigenada (líquido en líquido). Es una disolución de peróxido de hidrógeno (H2O2) en agua que se utiliza para desinfectar heridas y en la industria cosmética.
- Enfriamiento por hielo (sólido en líquido). Es una solución que ocurre cuando el hielo se introduce en el líquido y lo enfría, al tiempo que se disuelve.
- Suero fisiológico (sólido en líquido). Es una disolución formada por cloruro de sodio y agua, que actúa como solvente y que se usa para la hidratación de pacientes.
- Detergente (líquido en líquido). Es una solución usada para la limpieza de vajilla que está compuesta por elementos como agua, alcohol y sulfonato de sodio.
- Licuado (sólidos en líquidos). Es una sustancia que se obtiene al combinar alimentos sólidos, como frutas, y líquidos como el agua o la leche.
- Agua azucarada (sólidos en líquido). Es una disolución formada por agua y granos de azúcar.
- Leche chocolatada (sólidos en líquido). Es una disolución líquida que se obtiene al mezclar cacao en polvo, o barras de chocolate, con leche.
- Perfume. Es una disolución que surge de la mezcla de diferentes sustancias como el agua, el alcohol, colorantes, entre otras.
- Alcohol y agua (líquido en líquido). Es una disolución líquida que se obtiene al mezclar alcohol y agua. Esta solución se suele utilizar para la desinfección de superficies.
- Agua de mar. Es una disolución formada por sales, como el cloro, el magnesio y el sodio, disueltas en agua.
- Acero inoxidable. Es una aleación de hierro, carbono y cromo que se caracteriza por su resistencia y su no oxidación. Es usado para fabricar utensilios de cocina, electrodomésticos, muebles, maquinaria e instrumental quirúrgico.
- Latón. Es una aleación de cobre y zinc que se usa en cerrajería, en joyería, en componentes eléctricos, entre otros.
- Enjuague bucal. Es una solución líquida usada para la higiene bucal, que suele estar formada por componentes como agua, alcohol y aceites, y que ayuda a eliminar bacterias.
- Limpia pisos. Es una solución líquida que se usa para limpiar pisos y otras superficies y está formada por agua, alcohol y otros elementos que ayudan a eliminar virus y bacterias.
- Vinagre. Es una solución líquida formada por agua y ácido acético que se usa para aderezar comidas y también puede emplearse para la limpieza y desinfección de superficies.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)