Índice
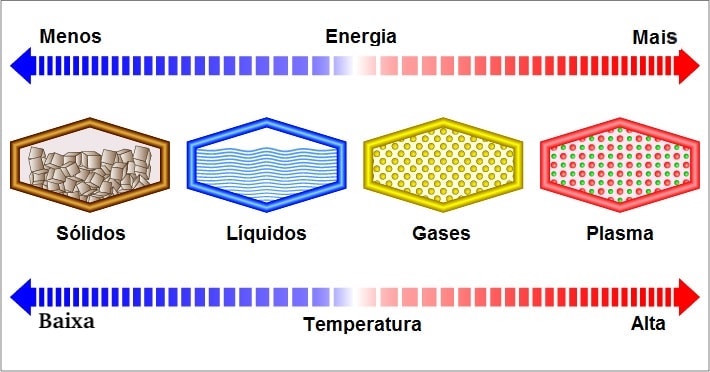
Quando se pensa em matéria, geralmente se supõe que há três estados nos quais ela pode se formar: sólido, líquido e gasoso. Esses são os três estados mais comuns, chamados de três estados de agregação, embora exista um quarto, chamado de “estado de plasma”, que só pode ocorrer sob temperaturas extremamente altas, deixando os átomos ionizados.
Os três estados de agregação convencionais são os que a química geralmente analisa; algumas substâncias, dependendo da temperatura a que são submetidas, podem se apresentar nas três formas à pressão de 1 atm: o melhor exemplo disso é a água.
Um ponto muito importante sobre os estados de agregação da matéria é que existe a possibilidade de passar de qualquer um dos três estados para qualquer outro.
Mudanças de estado de agregação:
- Fusão. A matéria é transformada de sólido para líquido por meio de um aumento na temperatura.
- Solidificação. A temperatura de um líquido é reduzida até que ele se torne sólido.
- Vaporização. A matéria é transformada de líquida para gasosa por meio de um aumento na temperatura.
- Condensação. A temperatura de um gás é reduzida até que ele se torne um líquido.
- Sublimação. A matéria passa de um estado sólido a estado gasoso por meio de um aumento repentino de temperatura e variação de pressão.
- Sublimação inversa. A temperatura é reduzida bruscamente até que se transforme novamente em um sólido (em nenhum dos casos o sólido se transforma em líquido antes de se transformar em gás).
- Veja também: Propriedades físicas e químicas da matéria
Sólidos
A matéria sólida é composta de partículas que estão fortemente unidas. As partículas podem se mover, mas em um grau muito pequeno, já que os sólidos não se difundem.
- Veja também: Sólidos
Características dos sólidos
- Os sólidos são caracterizados pela baixa elasticidade. Uma vez deformados, geralmente não retornam à sua forma original por conta própria.
- A forma e o volume são constantes, e eles não podem ser comprimidos (seu volume não pode ser reduzido por compressão). Entretanto, certos sólidos tendem a se expandir e contrair; aumentam de volume quando aquecidos e diminuem de volume quando resfriados.
- A subdivisão usual no que tange aos sólidos é entre os cristalinos (que têm uma estrutura atômica regular) e os amorfos (que são compostos de partículas ordenadas irregularmente).
Exemplos de sólidos
| Sal de mesa | Ferro | Grafite |
| Diamante | Açúcar | Feldspato |
| Gelo | Plásticos duros | Gesso |
| Âmbar | Magnetita | Carvão |
| Enxofre | Caulim | Silício |
| Quartzo | Madeira | Calcopirita |
| Pérolas | Areia |
Líquidos
Os líquidos são substâncias que também possuem um arranjo próximo ordenado das partículas. Entretanto, as forças de atração entre as partículas de um líquido são mais fracas, de modo que essas partículas se movem e colidem umas com as outras, vibrando e deslizando umas sobre as outras.
- Veja também: Líquidos
Características dos líquidos
- Os líquidos podem ter uma densidade semelhante à dos sólidos, mas se adaptam e fluem, tendo sempre a forma do recipiente que os contém.
- A viscosidade é uma característica dos líquidos, mas em um grau diferente, dependendo do caso.
- Outras propriedades típicas do estado líquido são a tensão superficial (devido às forças de atração em todas as direções entre as partículas que o compõem) e a capilaridade (a facilidade com que os líquidos podem subir por tubos de pequeno diâmetro).
Exemplos de líquidos (estado líquido)
| Água | Óleo comestível | Benzeno |
| Glicerina | Óleo de girassol | Saliva |
| Acetona | Sucos de frutas | Clorofórmio |
| Leite | Tolueno | Petróleo |
| Formol | Cristal líquido | Álcool etílico |
| Vinagre | Solução de ácido fosfórico | Mercúrio |
| Metal fundido | Líquido cefalorraquidiano |
Gasosos
O estado gasoso da matéria é muito diferente dos outros dois. As forças de atração são quase inexistentes, portanto, as partículas estão muito distantes umas das outras.
Características dos gases
Algumas características do estado gasoso são:
- O movimento das partículas é rápido e descontrolado, e elas se movem mesmo a longas distâncias. Por isso, o gás assume o tamanho e a forma do local que ocupa.
- A densidade dos diferentes tipos de gases é muito menor do que a dos líquidos e sólidos, e os gases são rapidamente compreensíveis.
- As leis dos gases (contribuição de Charles e Gay-Lussac) explicaram as propriedades mais importantes dos gases, referentes à relação entre as pressões e as temperaturas dos gases.
Exemplos de estado gasoso (gases)
| Dioxigênio | Dicloro | Criptônio |
| Di-hidrogênio | Diflúor | Gás lacrimogêneo |
| Vapor de água | Butano | Neón |
| Dinitrogênio | Ozônio | Balões de gás |
| Argônio | Metano | Gás sulfídrico |
| Hélio | Nuvens no céu | Amônia |
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)