Índice
- Tipos de aminas
- Nomenclatura de las aminas
- Propiedades físicas de las aminas
- Propiedades químicas de las aminas
- Ejemplos de aminas
- Función biológica de las aminas
- Usos de las aminas
- Toxicidad de las aminas
Las aminas son compuestos químicos orgánicos derivados del amoníaco (NH3), donde al menos uno de los hidrógenos del amoníaco ha sido sustituido por un grupo alquilo o arilo, lo que dio como resultado la formación de un grupo amino (-NH2, -NH-, -N=). Por ejemplo: metilamina, etilamina y propilamina.
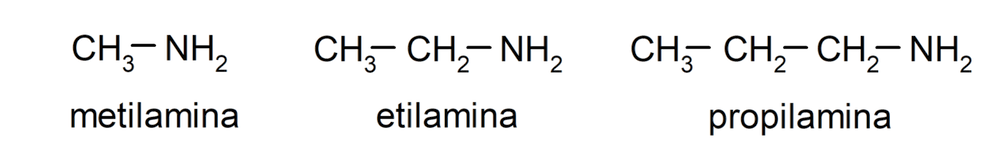
Un grupo alquilo es un sustituyente que se forma cuando se separa un hidrógeno de un hidrocarburo saturado. De esta manera, el carbono del que se separó ese hidrógeno puede enlazarse a otro átomo. Por ejemplo: metilo (CH3 -) y etilo (CH3 – CH2 -).
Un grupo arilo es un sustituyente derivado de un anillo aromático, como el benceno. Por ejemplo: fenil (C6H5 -)
Tipos de aminas
Las aminas se pueden clasificar según la cantidad de átomos de hidrógeno unidos al nitrógeno que han sido sustituidos por grupos funcionales alquilo o arilos.
Según este criterio, existen:
- Aminas primarias. Se forman cuando solo uno de los átomos de hidrógeno del amoníaco es sustituido por un grupo alquilo o arilo. Por ejemplo: etilamina y 1-pentilamina.
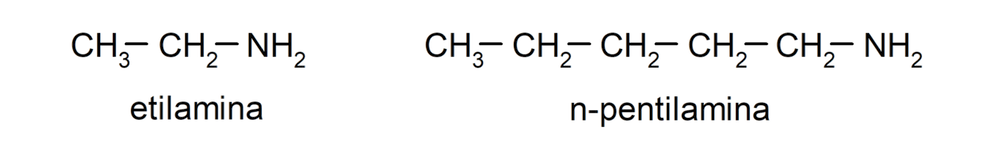
- Aminas secundarias. Se forman cuando dos de los átomos de hidrógeno del amoníaco son sustituidos por un grupo alquilo o arilo. Por ejemplo: dietilamina y etilmetilamina.

- Aminas terciarias. Se forman cuando los tres átomos de hidrógeno del amoníaco son sustituidos por un grupo alquilo o arilo. Por ejemplo: trimetilamina y dimetiletilamina.
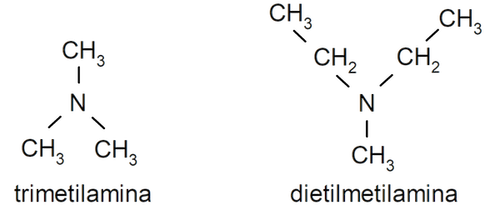
Las aminas también se clasifican según el tipo de grupo que está unido al nitrógeno. Según este criterio, existen:
- Aminas alifáticas. Presentan sustituyentes alquilo. Por ejemplo: butilamina y dietilamina.
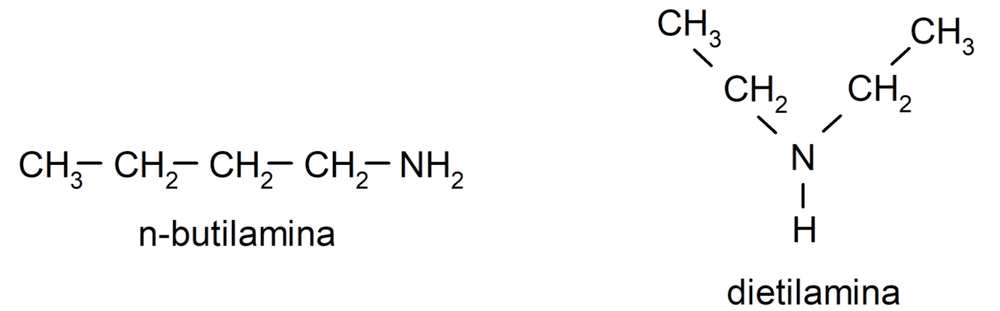
- Aminas aromáticas. Presentan sustituyentes arilo. Por ejemplo: fenilamina (anilina) y difenilamina.
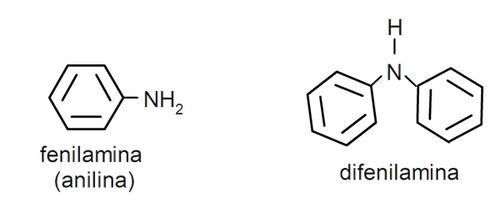
Nomenclatura de las aminas
Según la IUPAC (Unión Internacional de Química Pura y Aplicada), las aminas se nombran siguiendo las siguientes reglas:
Para las aminas más sencillas, se nombra cada uno de los sustituyentes de los grupos hidrógeno enlazados al nitrógeno del amoníaco. Luego se coloca al final del nombre la palabra “amina”.
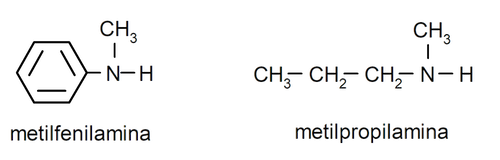
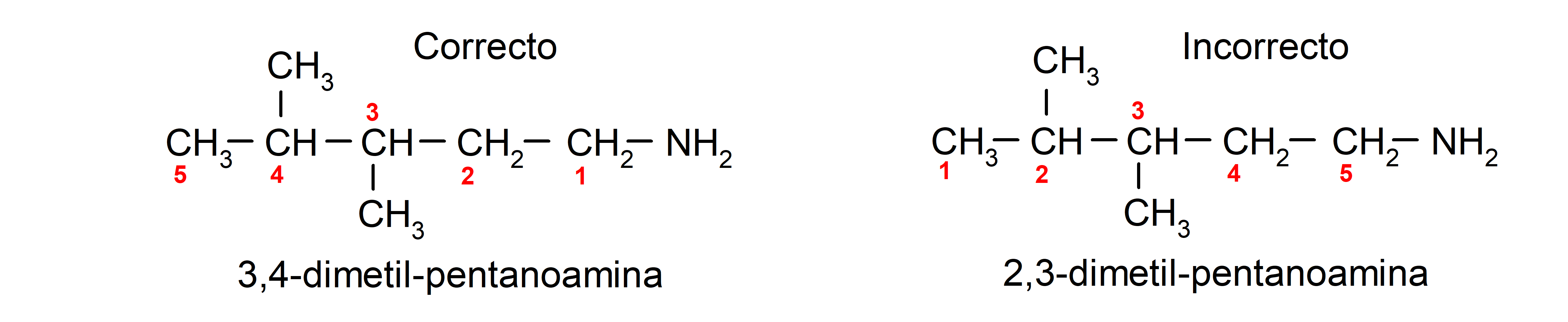
Para aminas que contienen varias cadenas carbonadas (que a su vez, tienen otros sustituyentes), se elige como principal la cadena carbonada que contiene el grupo amino. Además, se elige la posición del grupo amino de manera que ocupe la menor posición en la cadena carbonada, y en base a esta posición, también se eligen los sustituyentes de forma que ocupen la menor posición posible en la cadena.
Finalmente, se nombran usando para la cadena principal el nombre del alcano, alqueno o alquino correspondiente, y se coloca el sufijo amina.
Si la cadena carbonada contiene varios grupos amino, se eligen en la posición que ocupen en la menor combinación de la numeración de sus posiciones. Además, se coloca el nombre del alcano, alqueno o alquino correspondiente, seguido del término que indica la cantidad de grupos amino, seguido del sufijo “amina”.

Propiedades físicas de las aminas
Las propiedades físicas de las aminas dependen en gran medida de cuántos hidrógenos unidos al nitrógeno hayan sido sustituidos, y por qué tipo de sustituyentes han sido sustituidos.
- Solubilidad. De manera general, las aminas son más solubles en agua que los correspondientes hidrocarburos saturados. Además, las aminas con largas cadenas carbonadas son menos solubles en agua que las aminas de cadenas carbonadas cortas. Por otra parte, las aminas aromáticas no son solubles en agua.
- Punto de ebullición. El punto de ebullición de las aminas es más alto que el de los alcanos con igual número de átomos de carbono.
- Olor. La mayoría de las aminas tienen olores desagradables. Por ejemplo, la putrescina tiene olor a carne en descomposición y la trimetilamina huele a pescado podrido.
Propiedades químicas de las aminas
Algunas propiedades químicas de las aminas son:
- Son compuestos químicos básicos, es decir, que experimentan reacciones donde aceptan protones según la Teoría de Brønsted-Lowry. Por ejemplo:

- Presentan reacciones neutralización con ácidos en las que se forman sales de aminas. Por ejemplo:

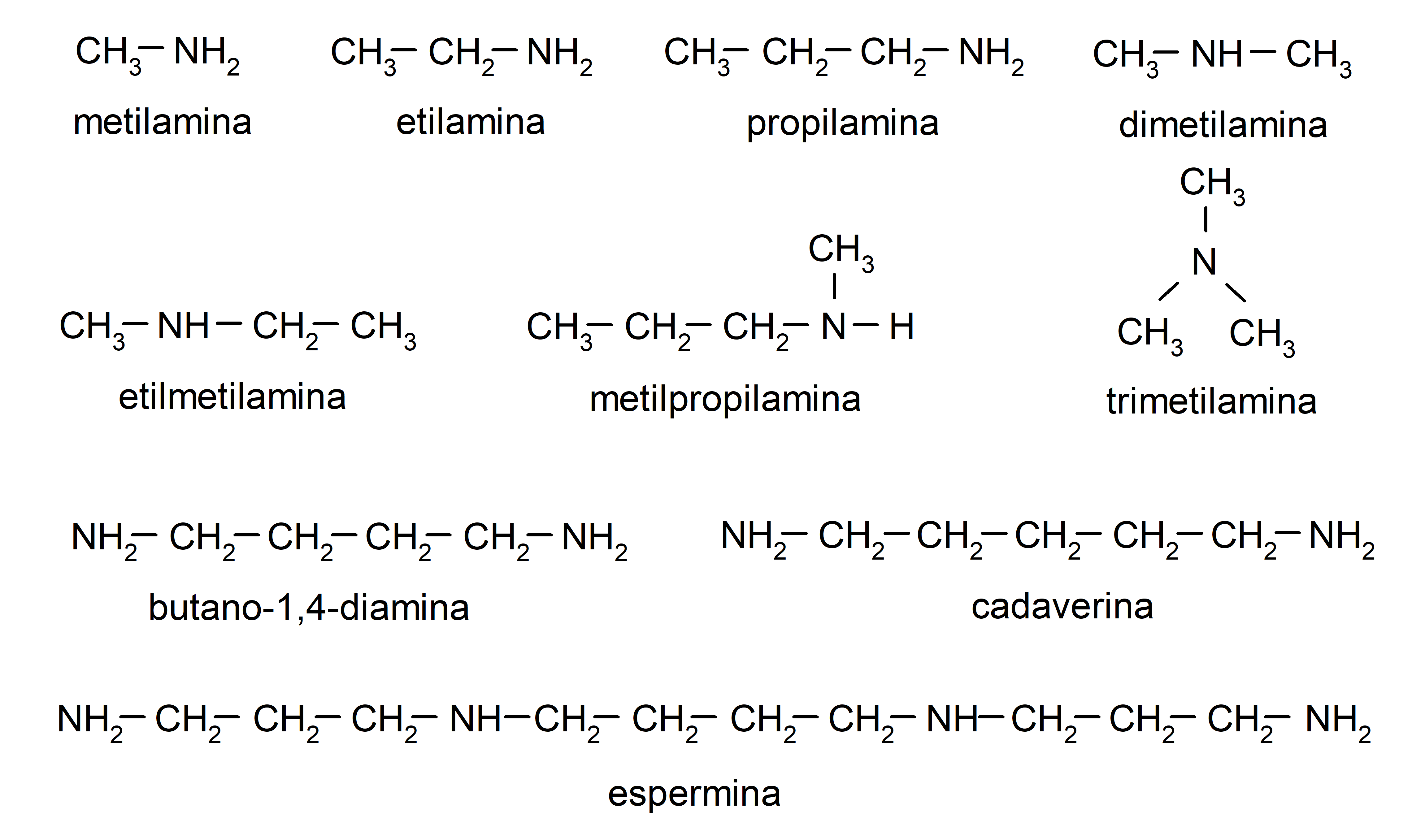
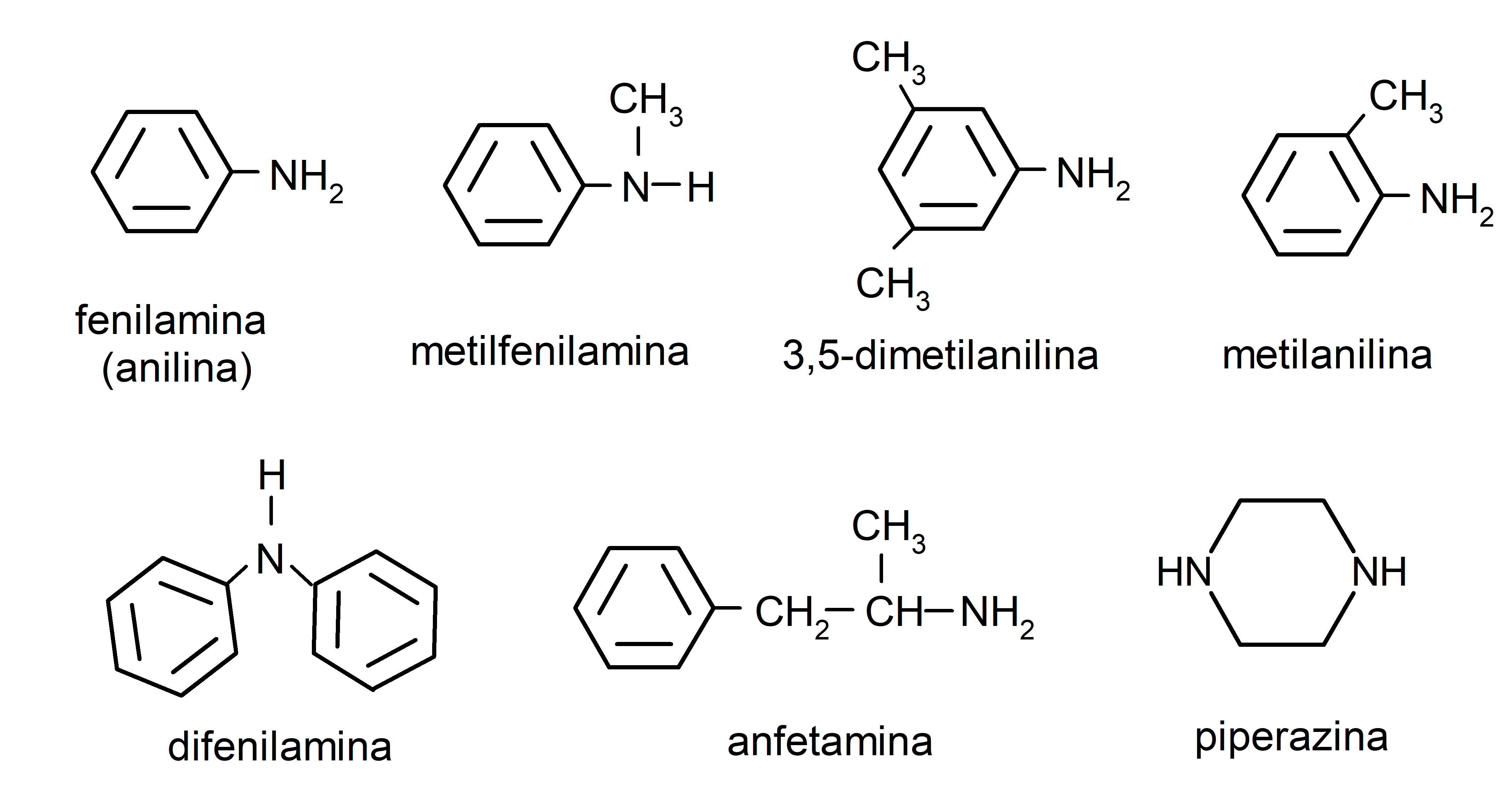
Ejemplos de aminas
- metilamina
- etilamina
- propilamina
- dimetilamina
- etilmetilamina
- fenilamina (anilina)
- difenilamina
- metilpropilamina
- butano-1,4-diamina
- espermina
- cadaverina
- 3,5-dimetilanilina
- metilanilina
- anfetamina
- piperazina
Función biológica de las aminas
Las aminas están presentes en muchos seres vivos y cumplen diversas funciones. Algunas aminas, como la epinefrina, la norepinefrina, la serotonina y la dopamina, son neurotransmisores.
El grupo amino es uno de los grupos funcionales que forman los aminoácidos, que son las unidades fundamentales de las proteínas. Además, las bases nitrogenadas que forman el ADN y el ARN contienen grupos amino.
Usos de las aminas
Algunos usos de la aminas son:
- Se utilizan para producir compuestos agroquímicos y farmacéuticos.
- Se emplean como catalizadores en la producción de poliuretanos.
- Debido a su efecto amortiguador, se utilizan para inhibir la corrosión en entornos acuosos.
- Se usan para depurar gases en centrales eléctricas y refinerías.
- Se utilizan para elaborar productos de limpieza.
- Se emplean para producir productos de cuidado personal, pues mejoran la formación de espuma en jabones y champú.
Toxicidad de las aminas
La inhalación de aminas en altas concentraciones provoca intoxicación, que a su vez ocasiona aumento de la presión arterial y convulsiones. Además, el contacto con aminas alifáticas en estado gaseoso provoca irritación en los ojos y en las vías respiratorias. Varias aminas provocan quemaduras en la piel al entrar en contacto con ellas.
Las aminas aromáticas son muy tóxicas, pero al ser mucho menos volátiles que las alifáticas, se puede controlar mejor el contacto con ellas.
Sigue con:
- Alcoholes
- Aldehídos
- Alcohol etílico
- Química orgánica
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)