Os alcenos são compostos que contêm ligações duplas carbono-carbono. Quando esses compostos têm estruturas de cadeia aberta, apresentam a fórmula molecular CnH2n (em que n é o número de átomos de carbono). Os alcenos também são chamados de olefinas e pertencem ao grupo dos hidrocarbonetos insaturados. São obtidos principalmente pela desidrogenação de alcanos. Por exemplo: eteno, propeno, ciclohexeno.
São compostos orgânicos que podem ser de cadeia curta, média ou longa; há também alcenos cíclicos ou cicloalcenos. Ao terem uma ligação dupla carbono-carbono, os alcenos possuem menos hidrogênios do que os alcanos correspondentes com o mesmo número de átomos de carbono.
Como são nomeados os alcenos?
Para nomear os alcenos, é necessário localizar a cadeia carbônica que contém o maior número de átomos de carbono e que também contém a ligação dupla. Se essa cadeia tiver várias ligações duplas, serão nomeados procurando-se a menor combinação possível das posições dessas ligações duplas.
A posição da ligação dupla é indicada intercalando, antes do sufixo -eno, o prefixo latino que indica o número do carbono onde começa a ligação dupla (di (2), tri (3), tetra (4), penta (5), octa (8) etc.). Os substituintes (comumente cloro, bromo, etil, metil, etc.) são nomeados como prefixos (no início do nome), detalhadamente e em ordem alfabética, além de serem nomeados procurando a menor combinação possível de suas posições na cadeia. Por exemplo: 1-buteno / 1,2-butadieno / 5-cloro-1-penteno / cloreto de 4-pentenilo
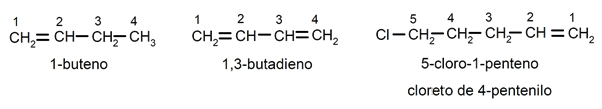
Devido à complexidade no nome químico estabelecido de acordo com os critérios da IUPAC, muitos alcenos orgânicos naturais têm nomes de fantasia, geralmente relacionados à sua fonte natural. Por exemplo: limoneno / 1-metil-4-(1-metiletenil)-ciclohexeno / geraniol / 3,7-dimetil-2,6-octadien-1-ol
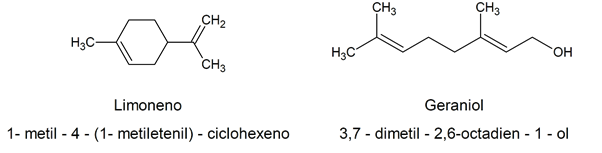
Os alcenos de até quatro carbonos são gases em temperatura ambiente, aqueles com 4 a 18 carbonos são líquidos e os mais longos são sólidos. Solubilizam-se em solventes orgânicos, como éter ou álcool, e são ligeiramente mais densos do que os alcanos correspondentes (ou seja, com o mesmo número de átomos de carbono).
Os pontos de fusão e ebulição dos alcenos, assim como os dos alcanos, aumentam quanto maior for a cadeia carbônica.
Por outro lado, devido à tensão gerada pela ligação dupla, a distância entre os átomos de carbono envolvidos na ligação dupla no alceno é de 1,34 pm (picômetros), enquanto a distância da ligação simples no alcano correspondente é de 1,54 pm.
Apresentam uma reatividade química muito maior do que os alcanos, justamente por terem estas ligações duplas com alta densidade eletrônica, que podem ser quebradas e permitir a adição de outros átomos, geralmente hidrogênio ou halogênios. Também podem sofrer oxidação e polimerização.
Os alcenos costumam apresentar isomeria cis-trans ou estereoisomeria, pois os átomos de carbono conectados pela ligação dupla não podem girar, e isso faz com que os substituintes estejam localizados no mesmo lado da ligação dupla ou em lados opostos. Por exemplo: trans-2-buteno / cis-2-buteno
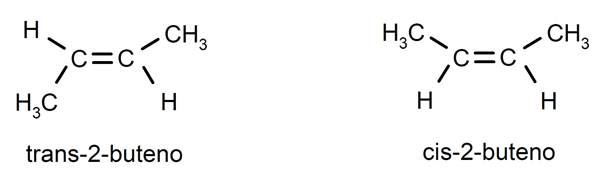
Os alcenos com duas ligações duplas são chamados de dienos e aqueles que têm mais de duas ligações duplas são genericamente chamados de polienos.
No mundo vegetal, os alcenos são bastante abundantes e têm funções fisiológicas muito importantes, como a regulação do processo de amadurecimento dos frutos ou a filtragem de determinadas radiações solares.
A estrutura química dos alcenos orgânicos costuma ser bastante complexa e inclui cadeias e anéis de carbono. Alguns legumes e frutas (como as cenouras e os tomates) e alguns crustáceos (por exemplo, os caranguejos) produzem quantidades significativas de betacaroteno, que é um importante alceno e precursor da vitamina A.
Exemplos de alcenos
- eteno
- 2-metilpropeno
- propeno
- 2,3-butadieno
- mirceno
- limoneno
- geraniol
- licopeno
- lanosterol
- mentofurano
- tetrafluoroetileno
- 1,3,5,7-ciclooctatetraeno
- 5-bromo-3-metil-3-hexeno
- 3,5-dietil-4-propil-2,5-dimetil-2-hepteno
- 7,7,8-trimetil-3,5-nonadieno
- 3,3-dietil-1,4-hexadieno
- ciclohexeno
- 1-cloro-2-metilprop-1-eno
- 3-bromo-5-metil-ciclopenteno
- 1-metil-ciclohexeno
Diagramas dos compostos químicos destes alcenos:


Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)