Índice
Um óxido é um composto químico que surge da combinação de um elemento metálico ou não metálico com o oxigênio. Por exemplo: óxido de cálcio (combinação entre cálcio e oxigênio), dióxido de enxofre (combinação entre enxofre e oxigênio).
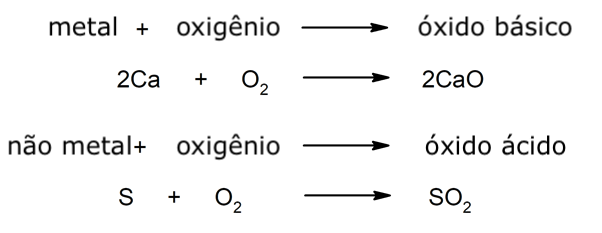
Geralmente, os óxidos se formam quando os elementos químicos se combinam com o ar ou a água, que têm um alto teor de oxigênio, causando desgaste nos elementos, especialmente quando se trata de metais. Para remediar esse problema, geralmente são usadas substâncias antioxidantes.
Nos óxidos, normalmente se classifica de acordo com o elemento com o qual o oxigênio é combinado:
- Óxidos básicos. São compostos químicos obtidos a partir da combinação de um elemento metálico com o oxigênio.
- Óxidos ácidos. São compostos químicos obtidos a partir da combinação de um elemento não metálico com o oxigênio.
- Óxidos anfóteros. São formados por um elemento anfótero e oxigênio, de modo que estes óxidos agem como ácidos ou bases, dependendo da reação em que estão envolvidos.
Para nomear esse tipo de substância, há três maneiras possíveis de fazê-lo, como as seguintes.
A nomenclatura Tradicional (ou estequiométrica)
Adiciona uma série de prefixos e sufixos ao nome do elemento (metálico ou não metálico), dependendo da quantidade de números de oxidação que possui.
Além disso, se for um óxido básico, é escrito “óxido de (nome do metal com seus respectivos prefixos e sufixos)” e, se for um óxido ácido, normalmente é escrito “anidrido (nome do metal com seus respectivos prefixos e sufixos)”.
Quando o elemento tem apenas um número de oxidação:
- “óxido (e o elemento com o sufixo incorporado -ico)”. Por exemplo: óxido potássico (K2O).
Quando o elemento tem dois números de oxidação:
- Para o número de oxidação mais alto: “óxido (e o elemento com o sufixo incorporado -ico)”. Por exemplo: óxido férrico (Fe2O3)
- Para o número de oxidação mais baixo: “óxido (e o elemento com o sufixo incorporado -oso)”. Por exemplo: óxido ferroso (FeO).
Quando o elemento tiver três números de oxidação:
- Para o número de oxidação mais baixo: “óxido (e o elemento com o prefixo ‘hipo’ e o sufixo -oso)”. Por exemplo: anidrido hipossulfuroso (SO).
- Para o número de oxidação intermediário: “óxido (e o elemento com o sufixo -oso)”. Por exemplo: anidrido sulfuroso (SO2).
- Para o número de oxidação mais alto: “óxido (e o elemento com o sufixo incorporado -ico)”. Por exemplo: anidrido sulfúrico (SO3). Neste caso, usamos a palavra “anidrido” porque o enxofre é um não metal, já que estamos falando de óxidos ácidos.
Quando o elemento tem quatro números de oxidação:
- Para o número de oxidação mais baixo: “óxido (e o elemento com o prefixo ‘hipo’ e o sufixo -oso)”. Por exemplo: anidrido hipocloroso (Cl2O).
- Para o número de oxidação seguinte: “óxido (e o elemento com o sufixo -oso)” Por exemplo: anidrido cloroso (Cl2O3).
- Para o seguinte número de oxidação: “óxido (e o elemento com o sufixo incorporado -ico)”. Por exemplo: anhídrido clórico (Cl2O5).
- Para o número de oxidação mais alto: “óxido (e o elemento com o prefixo ‘per’ e o sufixo -ico)” Por exemplo: óxido perclórico (Cl2O7).
A nomenclatura Sistemática
Esta nomenclatura é mais simples do que a tradicional, e o óxido é nomeado escrevendo-se a palavra “óxido de” e, em seguida, o nome do elemento, mas escrevendo-se antes de cada um deles o prefixo que corresponde ao número de átomos que ele tem no composto químico.
O prefixo mono- é para um único átomo, o prefixo di- para dois, tri- para três, o prefixo tetra- para quatro, o prefixo penta- para cinco, o prefixo hexa- para seis, o prefixo hepta- para sete e o prefixo octa- para oito.
- Nesse grupo estão incluídos, por exemplo: o monóxido de dicobre (Cu2O), o trióxido de dialumínio (Al2O3), o dióxido de carbono (CO2), ou o monóxido de diflúor (F2O).
A nomenclatura de Stock
A palavra “óxido” é escrita, seguida do nome do metal e do número de oxidação com o qual ele trabalha, entre parênteses e em algarismos romanos. De forma análoga à nomenclatura tradicional, é escrita da seguinte forma:
- óxido de cloro (I) para o óxido hipocloroso (Cl2O)
- óxido de cloro (III) para o óxido cloroso (Cl2O3)
- óxido de cloro (V) para o óxido clórico (Cl2O5)
- óxido de cloro (VII) para o óxido perclórico (Cl2O7)
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)