Las reacciones químicas se pueden clasificar en endotérmicas si absorben energía o exotérmicas, si liberan energía en forma de calor.
En las reacciones endotérmicas los productos tienen mayor entalpía (energía transferida en forma de calor a presión constante) que los reaccionantes, mientras que en las reacciones exotérmicas los productos tienen menor entalpía que los reaccionantes. Así, se establece el criterio:
- Variación de entalpía del sistema mayor que cero (ΔH > 0) → Reacción endotérmica
- Variación de entalpía del sistema menor que cero (ΔH < 0) → Reacción exotérmica
Las reacciones endotérmicas provocan un enfriamiento del entorno que las rodea, mientras que las reacciones exotérmicas provocan un calentamiento del entorno que las rodea.
Una reacción química es un proceso en el que especies químicas, llamadas reactivos o reactantes, cambian su estructura para transformarse en otras especies químicas, llamadas productos.
Ejemplos de reacciones endotérmicas
Algunos ejemplos de reacciones endotérmicas que ocurren en la naturaleza o en la vida cotidiana son:
La fotosíntesis
Es la reacción mediante la cual las plantas se nutren. En este proceso el dióxido de carbono (CO2) y el agua (H2O), con el aporte de energía luminosa, producen glucosa y oxígeno.
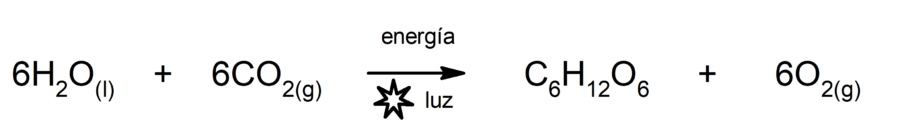
La electrólisis del agua
Es la reacción mediante la cual la molécula de agua se separa en oxígeno e hidrógeno cuando se le aplica energía eléctrica.
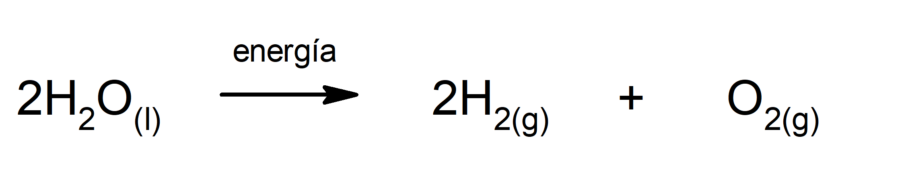
La generación de ozono atmosférico
Es la reacción mediante la cual, cuando interviene la radiación ultravioleta, se forma ozono (O3) a partir del oxígeno atmosférico (O2).

Ejemplos de reacciones exotérmicas
La combustión del metano (CH4)
Es la reacción mediante la cual se oxida rápidamente el metano, liberando energía y produciendo dióxido de carbono (CO2) y agua.
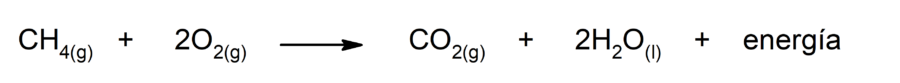
La reacción del sodio con el agua
Es la reacción mediante la cual el sodio reacciona con el agua, liberando calor y produciendo hidróxido de sodio (NaOH) y dihidrógeno (H2).
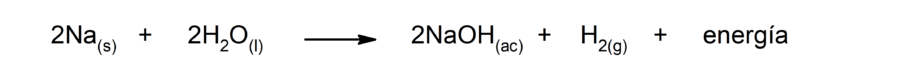
La oxidación de la glucosa
Es la reacción mediante la cual la glucosa se oxida, liberando energía en forma de ATP y produciendo dióxido de carbono (CO2) y agua (H2O).
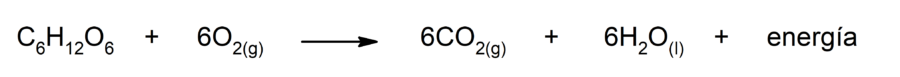
Sigue con:





¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)