Índice
Se llama puente de hidrógeno o enlace de hidrógeno a la fuerza de atracción electrostática que existe entre un átomo electronegativo y un átomo de hidrógeno, que a su vez está enlazado a otro átomo electronegativo. Por ejemplo: los puentes de hidrógeno formados entre las moléculas de amoníaco.
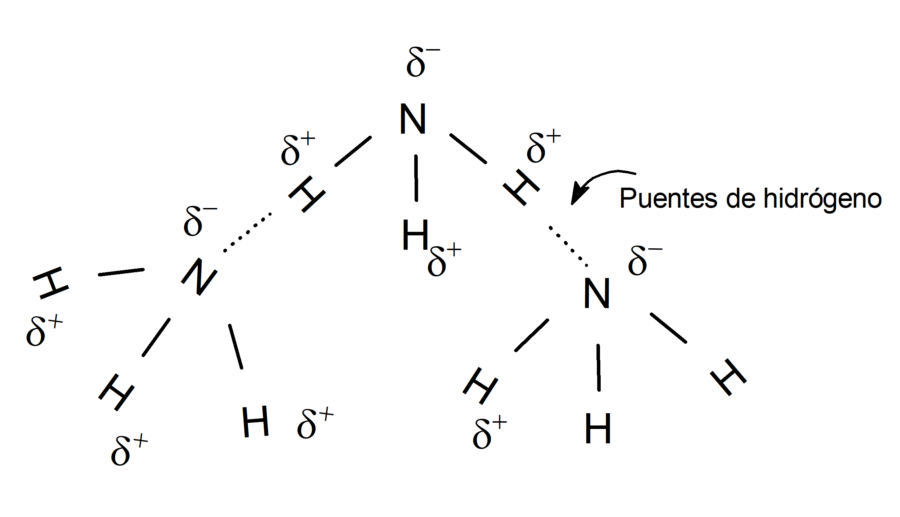
La energía de los puentes de hidrógeno es menor que la de los enlaces covalentes (enlaces formados por compartimiento de electrones entre átomos no metálicos) y la de los enlaces iónicos (enlaces formados por atracción electrostática entre iones con cargas de distinto signo).
Tipos de enlaces de hidrógeno
Los enlaces de hidrógeno pueden ser intermoleculares e intramoleculares:
- Enlaces intermoleculares. Son aquellos que se forman entre moléculas. Por ejemplo: los puentes de hidrógeno formados entre moléculas de ácido clorhídrico.

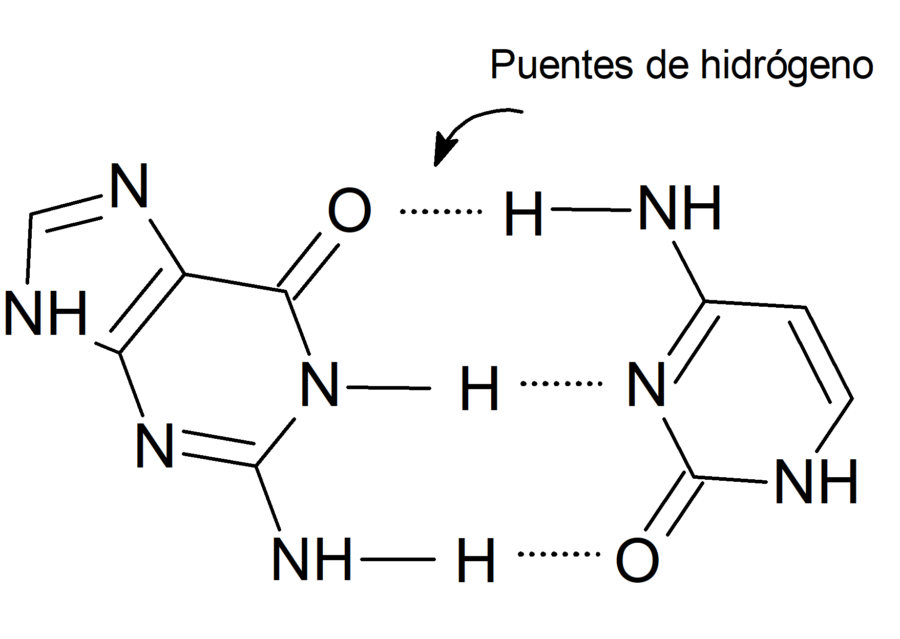
- Enlaces intramoleculares. Son aquellos que se forman en una misma molécula. Por ejemplo: los puentes de hidrógeno formados entre las bases nitrogenadas guanina y citosina, que pertenecen a una misma molécula de ADN.
Ver también:
Ejemplos de puentes de hidrógeno
- Puentes de hidrógeno entre moléculas de amoníaco.
- Puente de hidrógeno en la molécula de hidróxido de trimetilamonio.
- Puentes de hidrógeno entre moléculas de agua y ácido clorhídrico.
- Puentes de hidrógeno entre moléculas de metanol.
- Puentes de hidrógeno entre moléculas de agua y amoníaco.

Puentes de hidrógeno en la molécula de agua
Entre las moléculas de agua se forman puentes de hidrógeno, entre el átomo de oxígeno de una molécula de agua y un átomo de hidrógeno de otra molécula de agua.
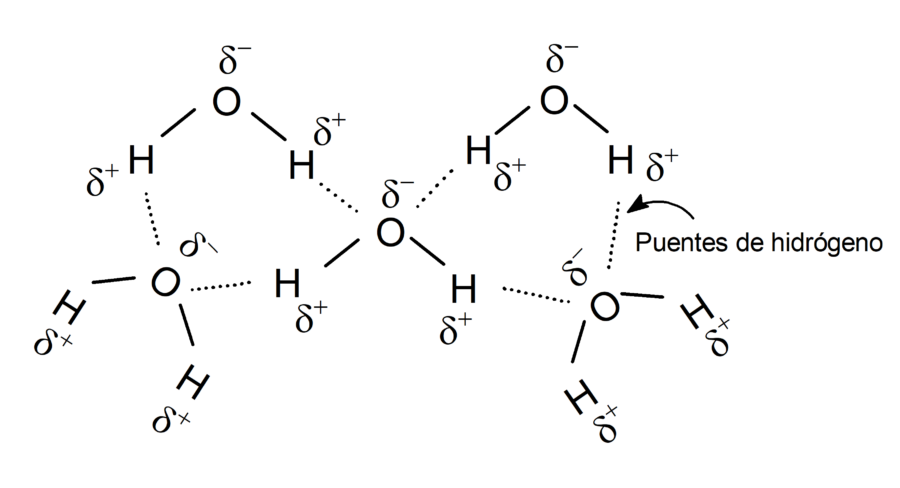
Los puentes de hidrógeno formados entre moléculas de agua son los responsables de varias propiedades que presenta el agua, como por ejemplo:
- Elevado punto de ebullición. Los puentes de hidrógeno entre moléculas de agua provocan atracción entre estas moléculas. Esto genera que sea más difícil que las moléculas se separen y pasen a la fase vapor cuando aumenta la temperatura.
- El agua sólida (hielo) es menos densa que el agua líquida. Por lo general, los sólidos son más densos que los líquidos, pero en el caso del agua, pasa lo contrario. Cuando se enfría el agua a una temperatura igual o menor que 4 °C, sus moléculas quedan prácticamente quietas, y entre sus átomos quedan espacios vacíos mayores que los que hay en las moléculas de agua líquida. Estos espacios son generados por la existencia de puentes de hidrógeno, que no permiten que los átomos se acerquen como para constituir un sólido más denso que el líquido.
- El volumen del hielo es mayor que el volumen del agua líquida. Cuando se enfría el agua a una temperatura igual o menor que 4 °C, su estructura adopta una forma cristalina, esto es posible debido a la presencia de los puentes de hidrógeno.
Importancia de los puentes de hidrógeno
Los puentes de hidrógeno son muy importantes para la existencia de los organismos vivos y para la constitución de muchas sustancias.
Juegan un papel fundamental en la estabilización de la forma de las moléculas de proteínas y de ADN. También son los responsables de que el agua sea líquida a temperatura ambiente. Por otro lado, están presentes en diversas moléculas que constituyen materiales que se utilizan en distintas industrias, como el vidrio y el acero.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)