Chama-se base química a qualquer substância que, quando dissolvida em água, libera íons hidroxila (ou hidróxido) (OH-). Por exemplo: hidróxido de cálcio, hidróxido de cobre, hidróxido de zinco.
As bases químicas também são conhecidas como álcalis, porque quando os grupos hidroxila (OH–) são dissociados e libertados, o pH das soluções aumenta, ou seja, a solução é alcalina. Isto é contrário ao que acontece quando se dissolve um ácido, pois nesse caso o pH diminui e a solução se acidifica.
As bases têm um sabor amargo característico. Após a dissolução, as soluções resultantes conduzem à corrente elétrica (pela presença de íons) e são geralmente cáusticas e irritantes para a pele e outros tecidos humanos e animais.
As bases neutralizam os ácidos, muitas vezes formando sais. As soluções alcalinas tendem a ser percebidas como escorregadias ou como sabão, isto acontece porque produzem imediatamente a saponificação das gorduras presentes na superfície da pele.
No caso dos hidróxidos, a sua solubilidade depende do metal: os do grupo (I) são os mais solúveis em água, enquanto os hidróxidos dos elementos com grau de oxidação (II) são menos solúveis e os de grau de oxidação (III) ou (IV) são quase insolúveis. As aminas e as bases dos ácidos nucleicos são as bases mais difundidas entre as orgânicas.
- Veja também: Ácidos e bases
Teorias que definem as bases
Existem diferentes teorias para definir as bases químicas:
- Teoria de Arrhenius. Estabelece que uma base é uma substância que quando se dissolve em água libera íons OH-. A desvantagem desta teoria é que está baseada na substância que deve estar em solução aquosa e conter OH- como parte de sua estrutura. Por esta razão, algumas bases como a amônia (NH3), que não têm OH-, não podiam ser explicadas através dela. Por exemplo, segundo Arrhenius, as substâncias de base são o hidróxido de sódio (NaOH) e o hidróxido de potássio (KOH).
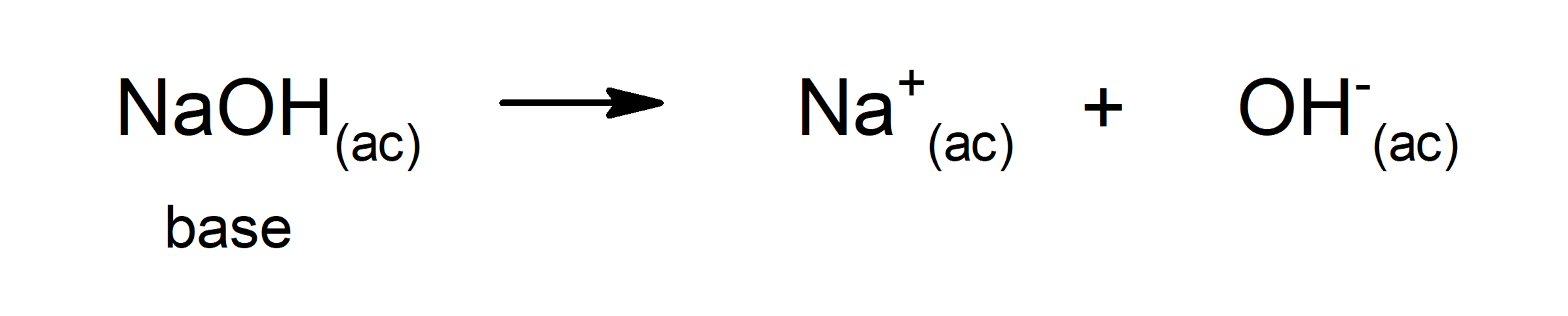
- Teoria de Brönsted e Lowry. Define uma base como uma substância que capta catiões H3O+ (H+) e que, além disso, está envolvida com o seu ácido conjugado, que é a substância que cede os cátions H+ que capta a base. Esta teoria resolve o inconveniente da teoria de Arrhenius sobre a necessidade de que as substâncias definidas como bases estejam em meio aquoso já que, segundo Brönsted e Lowry, as bases se definem em qualquer solvente. Por exemplo, algumas bases definidas por Brönsted e Lowry são a amônia (NH3) e o bissulfureto (HS-).
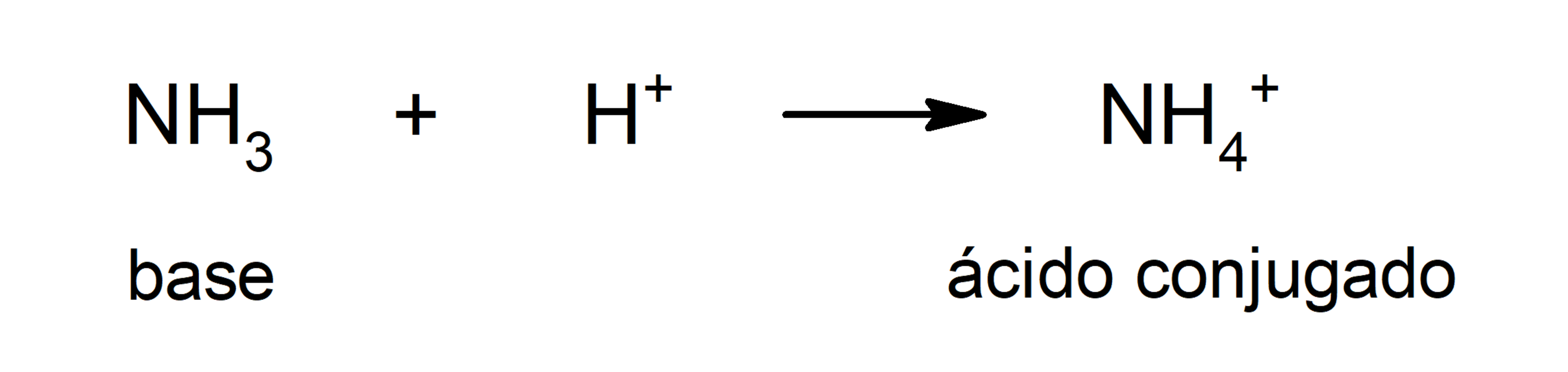
- Teoria de Lewis. Denomina uma base como uma substância que pode doar um par de elétrons. Por exemplo, o íon OH– e a molécula de amônia (NH3), que são bases segundo a definição de Lewis, já que têm um par de elétrons não enlaçantes que podem doar. Uma reação ácido-base, segundo esta teoria, pode ser representada como:

Assim, o íon OH– doa seu par de elétrons não enlaçante ao H+ para formar um enlace coordenado ou dativo (é um tipo de enlace covalente onde apenas um dos átomos que formam a este enlace fornece o par de elétrons), mediante o qual se forma molécula de água.
Usos das bases químicas
O hidróxido de sódio é muito utilizado na indústria: é a chamada soda cáustica. Na fabricação do sabão, utilizam-se gorduras animais ou vegetais, que são fervidas com hidróxido de sódio e, desta forma, forma-se estearato de sódio.
O hidróxido de sódio é também utilizado na produção de produtos de limpeza de fornos, na produção de polpa de papel e em alguns produtos de limpeza domésticos. Outra base muito utilizada é o hidróxido de cálcio, que é a cal que se usa na construção.
Exemplos de bases químicas
- Hidróxido de cálcio – Ca(OH)2
- Hidróxido de potássio – KOK
- Hidróxido de bário – Ba(OH)2
- Hidróxido de magnésio – Mg(OH)2
- Amônia – NH3
- Hidróxido de cobre (II) – Cu(OH)2
- Hidróxido de ferro (II) – Fe(OH)2
- Hidróxido de alumínio – AI(OH)3
- Hidróxido de zinco – Zn(OH)2
- Hidróxido de sódio – NaOH
- Hidróxido de níquel (II) – Ni(OH)2
- Detergente

Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)