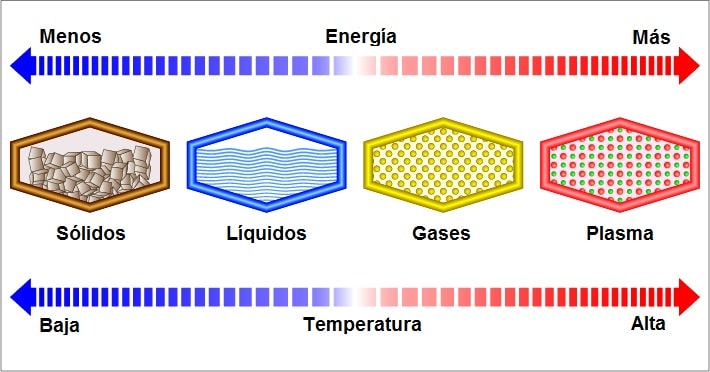
En general, cuando se habla de los estados de la materia se hace referencia a tres grandes grupos: sólido, líquido y gaseoso (aunque también existe el estado plasmático).
Los gases son un estado de la materia en el que las moléculas interaccionan débilmente a determinada temperatura y presión. Por ejemplo: biogas, monóxido de carbono, hidrógeno, metano.
En el estado gaseoso, las moléculas no están cohesionadas, por lo que los gases no constituyen un cuerpo consistente, con forma y volumen definido, como sí lo hacen los sólidos. Por esta razón es que los gases son, a menudo, imperceptibles a la visión, aunque algunos son perceptibles al olfato.
Los gases se expanden por todo el espacio disponible, es decir, adoptan la forma y volumen del recipiente que los contiene.
Cambios de estado:
- La transformación del estado sólido al gaseoso por aumento brusco de temperatura y variación de presión, sin pasar previamente por el estado líquido, se denomina sublimación.
- La transformación del estado líquido al gaseoso por aumento de temperatura se conoce como vaporización.
- La transformación del estado gaseoso al líquido por disminución de temperatura se llama condensación.
Características de los gases
- Son muy fáciles de comprimir.
- No tienen forma definida.
- En el estado gaseoso las moléculas se encuentran en permanente movimiento, colisionando las partículas entre sí y con las paredes del recipiente que las contiene.
- Estas partículas se mueven a distintas velocidades de acuerdo con una determinada temperatura.
- El movimiento es más rápido a elevadas temperaturas.
- Las fuerzas gravitatorias y de atracción resultan insignificantes en comparación con la tendencia al movimiento que tienen las partículas que componen los gases.
Investigaciones sobre los gases y el aire
Existen muchos estudios y aportes teóricos en física y química para analizar las características y el comportamiento de los gases.
El aire (que casi todos los seres vivos necesitamos para respirar) debe tener una composición determinada, con una suficiente cantidad de oxígeno. El dióxido de carbono también es un importante gas del aire, las plantas lo necesitan para llevar a cabo el proceso de fotosíntesis.
Ciertos gases no deben superar cierta proporción en el aire; de hecho algunos gases provenientes de ciertas industrias son sumamente tóxicos y nocivos para la salud, y pueden contaminar la atmósfera que respiramos (el monóxido de carbono es un ejemplo de ellos).

Propiedades de los gases
Entre las principales propiedades de los gases, encontramos:
- La expansión y la comprensibilidad (los gases se pueden comprimir por acción de una presión externa y expandirse si esta presión se deja de ejercer).
- La difusión (movimiento de las partículas de una zona de alta concentración a una zona de menor concentración) y efusión (cuando un gas está sometido a una presión en un recipiente y escapa al exterior por una abertura).
- La densidad de un gas es bastante baja.
El comportamiento de los gases se describió a través de las Leyes de los gases formuladas por científicos como Robert Boyle, Jacques Charles y Gay-Lussac. Estos físicos relacionaron parámetros como volumen, presión y temperatura de los gases, que se reúnen en la llamada Ley general de los gases.
- Ley de Boyle. Establece que el volumen de un gas es inversamente proporcional a la presión absoluta del recipiente que lo contiene a una temperatura y masa determinada del gas.
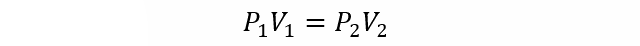
Donde:
P1 y P2 son las presiones inicial y final del gas respectivamente.
V1 y V2 son los volúmenes inicial y final del gas respectivamente.
- Ley de Jacques. Establece que el volumen de un gas es proporcional a su temperatura a una determinada presión.
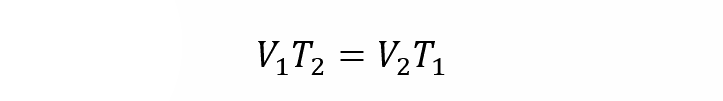
Donde:
T1 y T2 son las temperaturas inicial y final del gas respectivamente.
V1 y V2 son los volúmenes inicial y final del gas respectivamente.
- Ley de Gay-Lussac. Establece que la presión de un gas es directamente proporcional a la temperatura cuando el volumen es constante.
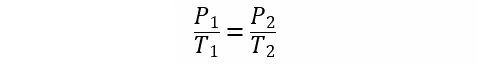
Donde:
T1 y T2 son las temperaturas inicial y final del gas respectivamente.
P1 y P2 son las presiones inicial y final del gas respectivamente.
Ejemplos de materia en estado gaseoso

- Emisiones que salen del caño de escape de un auto en marcha.
- Los gases usados en la refrigeración de heladeras y acondicionadores de aire.
- Las nubes del cielo, compuestas de vapor de agua.
- El dióxido de carbono en las bebidas gaseosas.
- El gas lacrimógeno, que produce una sensación desagradable en el cuerpo humano.
- Los globos de gas (rellenos con gas helio).
- El gas natural utilizado como combustible en la red domiciliaria.
- Biogas.
- El humo que se genera al quemar cualquier sólido.

- Monóxido de carbono
- Acetileno
- Hidrógeno
- Metano
- Butano
- Ozono
- Oxígeno
- Nitrógeno
- Gas sulfhídrico
- Helio
- Argón
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)