Os ácidos formam um importante e amplo grupo de compostos químicos. Em geral, os ácidos são definidos como compostos que podem doar um ou mais cátions de hidrogênio (H+) para outro composto, denominado base. No entanto, os ácidos também são definidos de acordo com várias teorias:
- Teoria de Arrhenius. Segundo esta teoria, um ácido é definido como uma substância que pode liberar íons H+ quando está em solução. Por exemplo: HCl(ac) e HBr(ac).
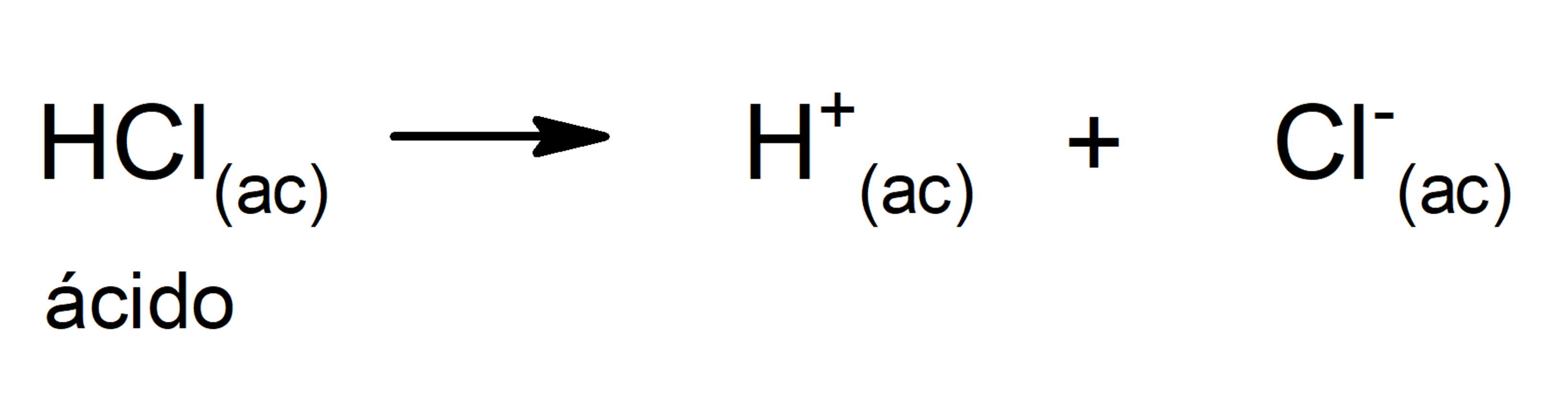
A limitação desta teoria é que os ácidos são definidos apenas em solução aquosa.
- Teoria de Brönsted e Lowry. Segundo esta teoria, um ácido também é definido como uma substância que libera um cátion H+, mas o libera a uma base que o aceita. Nesta teoria, os ácidos não precisam ser definidos em solução aquosa e, além disso, os ácidos orgânicos também podem ser explicados. Por exemplo: o ácido acético (CH3COOH).
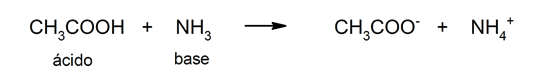
- Teoria de Lewis. Segundo esta teoria, um ácido é qualquer espécie química, molécula ou íon que recebe um par de elétrons de outra substância. Por exemplo: o cátion H3O+ (H+).

- Veja também: Ácidos e bases
Propriedades dos ácidos
Algumas das principais características dos ácidos são as seguintes:
- Podem se apresentar como líquidos ou gases e, mais raramente, como sólidos.
- Liberam cátions de hidrogênio e é isso que os leva a produzir soluções com pH abaixo de 7. Os ácidos que podem liberar mais de um próton (usando esse nome para H+) são chamados de polipróticos ou polifuncionais.
- É possível reconhecê-los por seu sabor azedo característico, por exemplo, nas frutas cítricas, que são ricas em ácido cítrico, ou no vinagre, que é uma solução de ácido acético (ambos ácidos orgânicos).
- Existem ácidos orgânicos e inorgânicos, sendo que normalmente os mais fortes são os inorgânicos. Muitos ácidos orgânicos têm funções biológicas importantes, como os ácidos nucleicos. Entre os inorgânicos, há um, o ácido clorídrico, que desempenha um papel importante no processo de digestão.
- São altamente corrosivos.
- Sua força é determinada pela tendência de perder prótons.
Tipos de ácidos
Os ácidos podem ser:
- Ácidos fortes. São compostos com grande tendência à dissociação, de forma que nada (ou quase nada) do ácido protonado permanece em solução. Os ácidos fortes costumam ser corrosivos, a tal ponto que podem causar queimaduras na pele. Em geral, são excelentes condutores de eletricidade. Por exemplo:
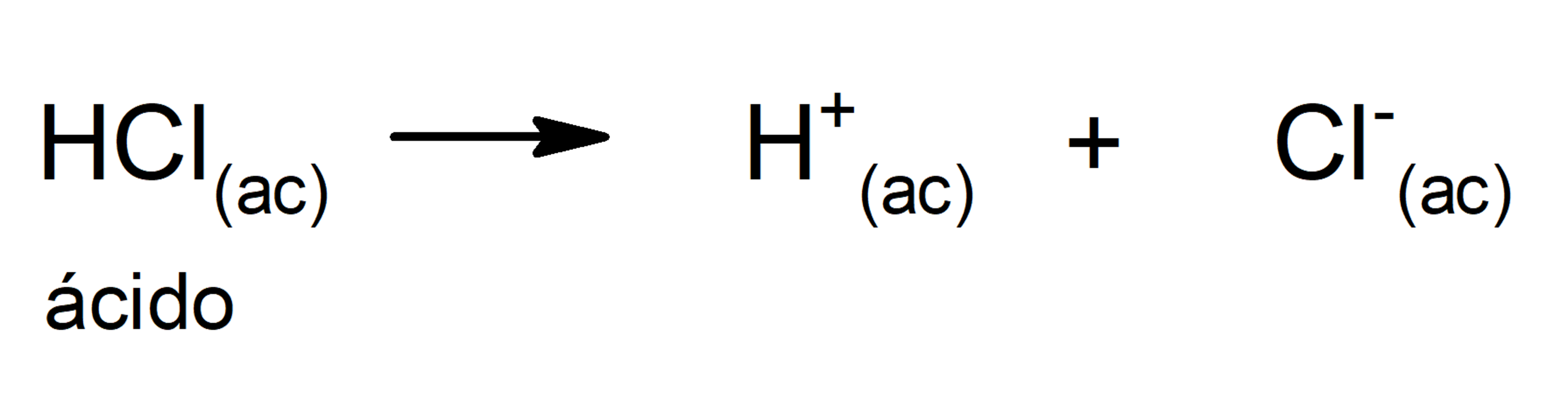
- Ácidos fracos. São compostos que se dissociam apenas parcialmente, de modo que há um equilíbrio entre a forma dissociada e a não dissociada. Por exemplo:
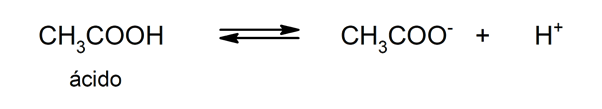
Exemplos de ácidos e seus usos na vida diária
Os ácidos têm uma infinidade de usos, tanto industrialmente quanto em casa. São frequentemente usados como aditivos e conservantes em alimentos, cosméticos e bebidas, como desinfetantes e como catalisadores (aceleradores de reações químicas) na indústria petroquímica ou de papel.
Entre os principais ácidos, destacam-se os seguintes:
- Ácido perclórico (HClO4). É um ácido forte e líquido à temperatura ambiente, altamente oxidante e muito usado no setor industrial. É empregado na fabricação de equipamentos elétricos e eletrônicos, em baterias, no refino de metais e na fabricação de fertilizantes e munições. Além disso, é usado em casa como limpador e removedor de ferrugem. Este ácido também está envolvido na produção de perclorato de amônio, que é usado na propulsão de foguetes, em explosivos e em fogos de artifício.
- Ácido nítrico (HNO3). É um ácido forte e altamente oxidante, usado na fabricação de certos explosivos, fertilizantes nitrogenados e como reagente de laboratório (dissolve quase todos os metais).
- Ácido ascórbico (C6H8O6). Também é chamado de vitamina C e é um nutriente necessário para a saúde humana. O ácido ascórbico é uma substância protetora devido aos seus efeitos antioxidantes que auxiliam o sistema imunológico, combate infecções, protege os tecidos, cura feridas, entre outras funções. Costuma ser encontrado na maioria das frutas e vegetais.
- Ácido clorídrico (HCl(ac)). É o único ácido forte que o corpo humano sintetiza, um processo que ocorre no estômago durante a decomposição dos alimentos no processo digestivo. Também é usado industrialmente no processamento de alimentos, na produção de aço e de baterias. O ácido clorídrico é usado como ingrediente em produtos de limpeza, desinfetantes e produtos químicos usados na limpeza de piscinas.
- Ácido tartárico (C4H6O6). É um pó branco cristalino usado na preparação de bebidas efervescentes, nos setores de panificação, vinícola e farmacêutico. O cremor de tártaro em algumas receitas é o ácido tartárico.
- Ácido fluorídrico (HF(ac)). Um ácido inorgânico altamente corrosivo. Devido à sua capacidade de atacar o vidro, é usado no corte e na gravação de vidro. Além disso, é usado para obter compostos farmacêuticos, como produtos de limpeza e para obter compostos orgânicos fluorados.
- Ácido sulfúrico (H2SO4). É um ácido forte que tem muitas aplicações em diversas indústrias e processos de síntese, entre elas se destacam: seu uso na produção de fertilizantes, na indústria petrolífera, na produção de baterias, entre outras.
- Ácido trifluoroacético (C2HF3O2). É um bom solvente para muitos compostos orgânicos, por isso é usado principalmente em síntese orgânica.
- Ácido fosfórico (H3PO4). É um ácido que está presente em vários refrigerantes, fertilizantes, detergentes, sabões e ração animal.
- Ácido acético (CH3COOH). É o principal componente do vinagre e, devido à sua acidez, é um conservante de alimentos amplamente utilizado. Esse ácido também é usado na fabricação de acetato de vinila, como solvente e como componente de produtos de limpeza. Também é usado no processo de revelação fotográfica e como material de contraste na área médica.
- Ácido fluoroantimônico (SbHF6). É o superácido mais forte conhecido e é usado para protonar (aceitar prótons) compostos orgânicos.
- Ácido crômico (H2CrO4). É um pó vermelho escuro empregado no processo de cromagem. Também é usado para esmaltar cerâmica, colorir e limpar vidro, na fabricação de tintas e na indústria de couro e madeira.
- Ácido indolacético (C10H9NO2). É o principal representante das auxinas, fitormônios (hormônios vegetais) que participam do processo de crescimento das plantas. Este processo inclui germinação, crescimento de raízes e frutos, crescimento de folhas, entre outros.
- Ácido desoxirribonucleico (ADN). É um ácido nucleico que contém todas as informações genéticas do organismo. O DNA compõe os genes que regem a síntese de inúmeras proteínas.
- Ácidos tricarboxílicos. É um grupo de ácidos carboxílicos que possui três grupos carboxílicos (-COOH). O ácido cítrico (C6H8O7) é um tipo de ácido tricarboxílico encontrado em muitas frutas e atua no organismo como antioxidante.
- Ácido fórmico (CH2O2). É o mais simples dos ácidos orgânicos e é usado na indústria de couro, na indústria química, na preservação de ração para animais, na indústria avícola e na indústria têxtil.
- Ácido glucônico (C6H12O7). É um ácido que possui sais que são empregados em processos de limpeza de objetos de vidro.
- Ácido lático (C3H6O3). É um ácido usado como aditivo na indústria alimentícia e para controlar a acidez. Também é usado na indústria de cosméticos, em produtos antienvelhecimento.
- Ácido benzoico (C7H6O2). É um ácido com odor característico usado para preservar alimentos que requerem um pH ácido. Também é empregado como componente de pasta de dente, em perfumaria, na indústria do tabaco e para amaciar plásticos.
- Ácido málico (C4H6O5). É um ácido orgânico largamente utilizado no setor farmacêutico para produzir laxantes. Além disso, é usado na indústria alimentícia, como aromatizante ou conservante, e na indústria vitivinícola.
- Ácido carbônico (H2CO3). É um ácido proveniente do dióxido de carbono e está presente em alimentos e bebidas, como refrigerantes, cervejas e alguns produtos lácteos. Também é encontrado no gelo seco e nos comprimidos efervescentes. O ácido carbônico é usado na indústria química, em câmaras de refrigeração e em sistemas de extinção de incêndios.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)