Índice
Na área da química, as substâncias chamadas bases (ou hidróxidos) são aquelas que, quando dissolvidas em água, liberam íons hidroxila (OH–) e ácidos são as substâncias capazes de liberar prótons (H+) em solução aquosa. Por exemplo: ácido sulfúrico, ácido nítrico, hidróxido de cálcio, hidróxido de potássio.
Classificação de ácidos e bases
De acordo com a sua tendência para a dissociação em íons, os ácidos e as bases se classificam em:
- Ácido forte. É um ácido que se ioniza completamente em solução aquosa. Por exemplo: HCl(ac), H2SO4(ac).
- Base forte. É uma base que ioniza completamente em solução aquosa. Por exemplo: NaOH(ac), KOH(ac).
- Ácido fraco. É um ácido que se ioniza parcialmente em solução aquosa, por isso que a concentração dos seus íons em solução é menor que a de um ácido forte. Por exemplo: ácido carbônico(H2CO3).
- Base fraca. É uma base parcialmente ionizada em solução aquosa, por isso que a concentração dos seus íons em solução é inferior à de uma base forte. Por exemplo: amoníaco (NH3).
Os ácidos diminuem o pH das soluções, as bases ou álcalis o aumentam. Os ácidos fortes são frequentemente corrosivos, algumas substâncias se dissolvem melhor em meios pouco acidificados ou alcalinizados.
- Veja também: Bases químicas
Exemplos de ácidos
Alguns ácidos conhecidos são:
- Ácido sulfúrico(HNO3). É um ácido forte com grande quantidade de utilização, sobretudo na indústria pesada, muito corrosivo e irritante. Quando diluído libera muito calor, por isso deve ser manuseado (como os outros ácidos fortes) com o máximo cuidado. É intensamente oxidante.
- Ácido clorídrico (HNO3). Embora seja um ácido forte, está presente no corpo humano, mais precisamente no estômago, onde desempenha uma importante função no processo digestivo. O excesso dele provoca azia.
- Ácido fosfórico (H3PO4). Este ácido é um ingrediente comum em bebidas gaseificadas. O consumo habitual de tais bebidas é desaconselhado pelo seu impacto negativo no metabolismo do cálcio, o que afeta principalmente ossos e dentes.
- Ácido nítrico (HNO3). É um reconhecido ácido forte, empregado para fabricar explosivos e fertilizantes nitrogenados, entre outros usos.
- Ácido perclórico (HClO4). É um ácido forte e líquido à temperatura ambiente. É um dos mais oxidantes.
- Ácido sulfídrico ou sulfeto de hidrogênio (H2S). É uma substância gasosa de forte e desagradável odor, tóxico em altas concentrações. Tem inúmeras aplicações industriais.
- Ácido ribonucleico. É um componente central dos ribossomos, fundamental para que se complete o processo global de síntese proteica a partir do ácido desoxirribonucleico.
- Ácido acetilsalicílico. É um ácido orgânico muito importante, com propriedades analgésicas e anti-inflamatórias. É a base da aspirina.
- Ácido lático. Provém da degradação da glucose durante o exercício anaeróbico de muita intensidade e pouca duração. Em condições normais, este ácido é reutilizado, mas se for acumulado, provoca danos nas fibras musculares, o que produz sobretudo cãibras.
- Ácido alílico. É um ácido presente em vegetais como o alho ou a cebola, derivado de um precursor também presente em tais espécies, a alicina. É germicida e anti oxidante.
- Ácido retinoico. Aplicado topicamente, inibe a queratinização, é utilizado em cremes contra acne e envelhecimento da pele. Deve ser utilizado sob prescrição médica.
- Ácido butírico (butanoico). É o produto final da fermentação de certos carboidratos realizada por microrganismos do rúmen. Normalmente, faz parte das gorduras animais em pequenas quantidades.
- Ácido propiônico. É um conservante alimentar, é utilizado para prevenir a deterioração fúngica e bacteriana de produtos de panificação e outros.
- Ácido benzoico. É utilizado como conservante adicionado a diferentes produtos (maioneses, produtos enlatados), frequentemente sob a forma de sal (benzoato de sódio).
- Ácido acético (CH3COOH). É um conservante de alimentos muito utilizado em casa, também como base de vinagretes e conservas. É o componente principal do vinagre.
- Ácido iodídrico (HI(ac)). É um ácido forte que pode ser utilizado para aumentar os níveis de iodo nos sais.
- Ácido succínico (C4H6O4). É um sólido cristalino que pode ser obtido a partir do âmbar. Pode ser gerado no processo de fermentação do vinho e da cerveja.
- Ácido bromídrico (HBr(ac)). É um ácido forte muito corrosivo. Sua reação com as bases é muito violenta, além disso é muito irritante. É utilizado na indústria química e farmacêutica.
- Ácido cítrico (C6H8O7). É um ácido orgânico abundante nas frutas e também é antioxidante natural.
- Ácido oxálico (H2C2O4). É um ácido orgânico que naturalmente se encontra nas plantas. É utilizado na apicultura para controlar doenças nas abelhas. Também é utilizado para fabricar produtos de limpeza, na indústria têxtil, entre outros usos.
Exemplos de bases
As bases de metais são geralmente conhecidas como hidróxidos. Algumas delas são:
- Hidróxido de sódio (NaOH, soda cáustica). É uma base forte, utilizada na indústria de papel e na fabricação de detergentes. Na vida cotidiana é usado para desentupir banheiros e cozinhas.
- Hidróxido de magnésio(Mg(OH)2, leite de magnésia). É uma base forte que às vezes se utiliza como antiácido ou laxante.
- Hidróxido de cálcio (Ca(OH)2, cal). Também conhecida como cal hidratada, é usada na indústria metalúrgica e petrolífera e para produzir pesticidas, na indústria açucareira e leiteira, entre outras.
- Hidróxido de potássio (KOH). É uma base forte e corrosiva que é muito utilizada em diferentes indústrias e para a fabricação de sabão.
- Hidróxido de bário (Ba(OH)2). Por sua toxicidade, é utilizada para fabricar venenos. Também é utilizado na indústria cerâmica, na indústria de papel e no processo de refinação de açúcar.
- Hidróxido de ferro II ou III (Fe(OH)2 ou Fe(OH)3). Geralmente é gerada como parte da indústria metalúrgica e utilizada na fabricação de tintas, entre outros usos.
- Amônia(NH3). É um gás com um odor característico. É usada para fabricar fertilizantes e muitas drogas. É muito perigosa se inalada em doses elevadas.
- Sabão. É um sal de sódio ou potássio. É utilizado para a higiene pessoal e geral.
- Detergente. Também é um produto muito utilizado para a higiene.
- Quinina. É uma base natural produzida por algumas plantas. Tem propriedades antipiréticas e analgésicas. No passado, foi usada para tratar a malária.
- Anilina. É um composto tóxico ao ser ingerido ou inalado. Emprega-se na indústria da borracha, na fabricação de herbicidas e explosivos, entre outros.
- Guanina. É uma das bases azotadas que fazem parte dos ácidos nucleicos (DNA e RNA).
- Pirimidina. As bases nitrogenadas que formam os ácidos nucleicos são derivadas da pirimidina.
- Citosina. É uma das bases azotadas que formam parte dos ácidos nucleicos.
- Adenina. É uma das bases nitrogenadas que formam parte dos ácidos nucleicos.
- Hidróxido de zinco (Zn(OH)2). É uma substância anfótera (pode atuar como ácido e como base ao mesmo tempo). É tóxica se em contato com os olhos ou pele. É utilizada no processo de fabricação de curativos cirúrgicos.
- Hidróxido de cobre (Cu(OH)2). É utilizado como fungicida e para dar cor a objetos cerâmicos, além de servir como catalisador de algumas reações químicas.
- Hidróxido de zircônio IV (Zr(OH)4). Utilizado na indústria cerâmica e de vidro.
- Hidróxido de berílio (Be(OH)2). Tem propriedades anfóteras. É utilizado na indústria para obter berílio metálico. É uma substância de abundância limitada.
- Hidróxido de alumínio (Al(OH)3, antiácido). É utilizado na medicina como antiácido e adjuvante de vacinas.
Teorias sobre ácidos e bases
O conceito de bases e ácidos têm variado com o tempo. Foi Arrhenius quem elaborou a primeira definição, que afirma um ácido como sendo uma substância que em solução aquosa cede íons H+, e a uma base como uma substância que em solução aquosa cede íons OH–. Sua teoria tinha algumas limitações, dado que certas substâncias (como a amônia) se comportam como bases sem ter em sua molécula o íon hidroxilo.
Além disso, Arrhenius considerou apenas as substâncias em meio aquoso, mas as reações ácido-base também ocorrem em outros meios de dissolução não aquosos. Uma representação de um ácido e uma base segundo a teoria de Arrhenius é:
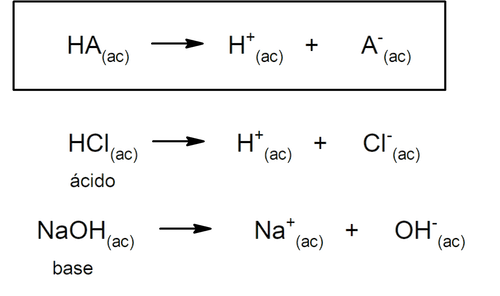
Quase quarenta anos mais tarde, por volta de 1923, Brönsted e Lowry formularam outra teoria, afirmando que os ácidos e as bases funcionam como pares conjugados. Segundo esta teoria, o ácido é aquela substância capaz de ceder prótons (neste caso não se refere aos prótons do núcleo atômico, mas aos cátions H+, sendo também H+ uma abreviatura do cátion H3O+) e a base é aquela substância capaz de aceitar esses prótons.
Esta teoria sugere que em uma reação ácido-base, uma base conjugada é a espécie química que se forma depois que um ácido doa um próton, e um ácido conjugado é a espécie química que se forma depois que a base aceita um próton. Esta teoria não é completa, uma vez que existem várias substâncias que apresentam propriedades ácidas sem dispor de átomos de hidrogênio ionizáveis na sua estrutura.
Por outro lado, nesta teoria não é obrigatório que as substâncias existam em solução aquosa. Uma representação de um ácido (e sua base conjugada) e uma base (e seu ácido conjugado), segundo a teoria de Brönsted – Lowry é a protonação da amônia, que não tem que ocorrer em meio aquoso:
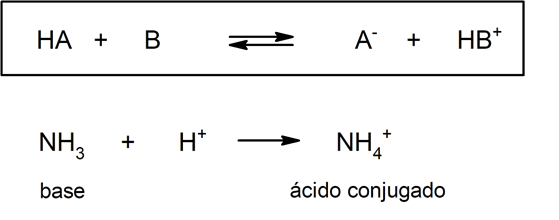
Por isso, como uma parte adicional da sua teoria sobre a ligação covalente, Lewis desenvolveu uma teoria na qual define um ácido como toda aquela substância que pode aceitar um par de elétrons, enquanto que uma base é toda substância capaz de ceder este par eletrônico.
Segundo Lewis, os conceitos de ácido e de base não envolvem ganho ou perda de íons OH– e H+, mas, propõe que o próprio H+ seja o ácido (pode aceitar elétrons) e o OH– é a base (pode doar elétrons). Uma representação de uma reação ácido-base, segundo a teoria de Lewis é:

Onde o OH– (que pertence ao NaOH) doa o par de elétrons não compartilhado ao H+ (que pertence ao HCl), como resultado, forma-se uma ligação coordenada ou dativa (ligação covalente, na qual o par de elétrons compartilhado é fornecido por apenas um dos átomos envolvidos nesta ligação) para formar a molécula de água.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)