Índice
Os alcanos são um tipo de hidrocarboneto composto por uma estrutura constituída por um número variável de átomos de carbono unidos entre si por ligações simples. Por sua vez, cada átomo de carbono está ligado a átomos de hidrogênio, que podem ser substituídos por outros átomos ou grupos funcionais. Por exemplo: clorofórmio, metano, octano.
A fórmula molecular dos alcanos de cadeia linear aberta é CnH2n+2: C representa o carbono, H o hidrogênio e n o número de átomos de carbono. Os alcanos são hidrocarbonetos saturados, ou seja, não têm ligações duplas ou triplas. Para nomeá-los, usa-se o sufixo “-ano”, depois de nomear a cadeia carbônica usando o prefixo correspondente à quantidade de átomos de carbono (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7)).
- Veja também: Combustíveis na vida diária
Classificação dos alcanos
Dentro dos alcanos, costuma-se reconhecer dois grupos principais: os alcanos de cadeia aberta (também chamados de alcanos acíclicos) e os alcanos de cadeia fechada (ou alcanos cíclicos).
Quando os compostos de cadeia aberta não apresentam nenhuma substituição dos hidrogênios que acompanham cada átomo de carbono, recebem o nome de alcanos lineares e são os alcanos mais simples. Quando apresentam qualquer substituição de algum de seus hidrogênios por uma ou mais cadeias de carbono, são chamados de alcanos ramificados. Os substituintes mais comuns são os grupos etil (CH3CH2-) e metil (CH3-).
Por sua vez, há compostos com um único anel na molécula (monocíclicos) e outros com vários (policíclicos). Os cicloalcanos podem ser homocíclicos (formados exclusivamente com a presença de átomos de carbono) ou heterocíclicos (envolvendo outros átomos, por exemplo, oxigênio ou enxofre).
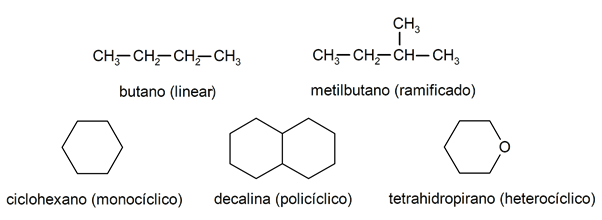
Propriedades físicas dos alcanos
Em geral, as propriedades físicas dos alcanos são condicionadas pela massa molecular (por sua vez, ligada ao comprimento da cadeia carbônica).
- Estado de agregação. Os alcanos com um menor número de átomos de carbono são gasosos à temperatura ambiente, os que têm de 5 a 18 átomos de carbono são líquidos e os que têm mais de 18 átomos de carbono são sólidos (tipo cera).
- Relação com a água. Como são menos densos que a água, os alcanos tendem a flutuar sobre ela, em geral são insolúveis em água e solúveis em solventes orgânicos.
- Pontos de ebulição e fusão. Os pontos de ebulição e de fusão dos alcanos dependem de sua massa molecular, ou seja, do comprimento da cadeia carbônica, embora muitas vezes também dependam da disposição espacial dos átomos. Os alcanos lineares e cíclicos têm pontos de ebulição mais altos do que os alcanos ramificados.
Propriedades químicas dos alcanos
Algumas das principais propriedades químicas dos alcanos são:
- São compostos químicos com reatividade muito baixa, motivo pelo qual também são conhecidos como “parafinas” (em latim, parum affinis significa “pouca afinidade”.
- São compostos que têm uma energia de ativação muito alta quando envolvidos em reações químicas. A reação mais importante que podem experimentar é a combustão e geram, na presença de oxigênio, calor, dióxido de carbono e água.
- São a base de uma grande variedade de reações associadas a processos industriais de suma importância, sendo os combustíveis mais tradicionais.
- Aparecem como produtos finais de processos biológicos, como a fermentação metanogênica realizada por alguns microrganismos.
Exemplos de alcanos
- Triclorometano (CHCl3)
- Metano (CH4)
- Etano (C2H6)
- Propano (C3H8)
- Butano (C4H10)
- Octano (C8H18)
- Hexano (C6H14)
- Icosano (C20H42)
- Pentano (C5H12)
- n-heptano (C7H16)
- 2-metilbutano (C5H12)
- 3-cloro-4-n-propilheptano (C10H21Cl)
- 1-bromo-2-feniletano (C8H9Br)
- 3-etil-4-metil-hexano (C9H18)
- cubano (C8H8)
- 1-bromopropano (C3H7Br)
- 3-metil-5-n-propiloctano (C12H26)
- 3,3-dimetildecano (C12H26)
- Ciclopropano (C3H6)
- 3-etil-2,3-dimetil-pentano (C9H20)
Os alcanos na vida diária
Alguns dos principais usos dos alcanos são os seguintes:
- Clorofórmio (triclorometano). Os vapores dessa substância costumavam ser usados como anestésico, mas depois foram proibidos porque se descobriu que danificavam órgãos vitais, como o fígado e os rins. Atualmente, o triclorometano é usado como solvente e refrigerante.
- Metano. É o alcano mais simples e é composto por um átomo de carbono e quatro de hidrogênio. Trata-se de um gás que se apresenta naturalmente, produzido pela decomposição de diferentes substratos orgânicos, e é o principal componente do gás natural usado para produzir eletricidade. O metano também é usado na indústria química e é um dos principais gases de efeito estufa.
- Etano. É um alcano empregado na produção de etileno (um composto largamente utilizado na indústria), para gerar energia e na produção de plásticos e detergentes.
- Propano. É um gás usado como combustível elétrico em residências e na indústria. É empregado para aquecer ambientes, aquecer água e em fornos e fogões. Além disso, é usado como combustível para veículos.
- Octano. É um alcano de oito carbonos e é de grande importância porque determina a qualidade final da gasolina. Esta qualidade é medida pelo índice de octanos ou octanagem do combustível, que toma como referência uma baixa detonação (índice 100) e uma alta detonação (índice 0).
- Hexano. É um solvente importante e, em virtude de sua alta toxicidade, não é usado com frequência.
- Butano. Ao lado do propano (C3H8), formam os chamados gases liquefeitos de petróleo (GLP), que são formados em bolsões de gás durante os processos de extração de petróleo. Atualmente, promove-se a substituição da gasolina ou do diesel pelo GLP, por ser um hidrocarboneto mais amigável ao meio ambiente.
- Pentano. É um alcano líquido usado como solvente e que faz parte de algumas gasolinas.
- Icosano. É um alcano de vinte carbonos (o prefixo “ico” significa vinte) e costuma ser usado na fabricação de cosméticos e lubrificantes.
- Ciclopropano. É um alcano usado antigamente como anestésico, mas que foi substituído por outras substâncias.
- n-heptano. É um alcano que serve de referência para o ponto zero na escala de octanagem da gasolina, que vem a ser o menos desejável, pois tem combustão explosiva. É obtido a partir da resina de certas plantas e usado como solvente. Também é usado na indústria petrolífera e, em menor escala, como combustível.
- 3-etil-2,3-dimetil-pentano. É um composto usado como solvente e como componente da gasolina.
- 2-Metilbutano. É um composto líquido altamente inflamável, também chamado de isopentano, frequentemente usado como solvente, na fabricação de plásticos e na indústria química.
- Continue com: Propriedades físicas e químicas da matéria
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)