Os hidróxidos resultam da combinação de um óxido metálico (também chamado de óxidos básicos) e água. Assim, a composição dos hidróxidos é formada por três elementos: oxigênio, hidrogênio e o metal em questão. Na combinação, o metal sempre atua como um cátion e o grupo hidróxido (OH–) atua como um ânion. Por exemplo:
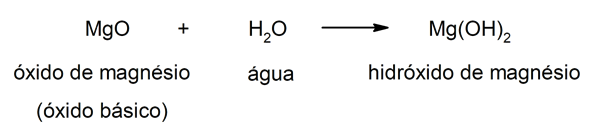
Os hidróxidos, em geral, compartilham várias características, como apresentar um sabor amargo e ser cáustico. Além disso, costumam ser escorregadios ao toque e corrosivos. Por outro lado, possuem algumas propriedades de detergentes e sabões. A maioria é solúvel em água e reage com ácidos para produzir sais.
Algumas características, no entanto, são próprias de cada tipo de hidróxido, como o de sódio (NaOH), que absorve água e, misturado com cal viva (CaO), absorve rapidamente o dióxido de carbono (CO2). Por sua vez, o hidróxido de cálcio (Ca(OH)2) é obtido pela reação do óxido de cálcio com a água e também absorve CO2. Outro exemplo é o hidróxido de ferro (II) (Fe(OH)2), que é um composto gelatinoso e praticamente insolúvel em água.
Os hidróxidos também são chamados de bases ou álcalis, apesar de estes termos terem sido estendidos a outras substâncias com caráter alcalino e que não são hidróxidos.
- Veja também: Óxidos ácidos
Para que os hidróxidos são usados?
As aplicações dos hidróxidos também variam conforme o caso:
- O hidróxido de sódio, por exemplo, está associado à indústria de sabão e a produtos de beleza e cuidados com o corpo.
- O hidróxido de cálcio, por outro lado, desempenha um papel intermediário em alguns processos, como a obtenção de carbonato de sódio (Na2CO3).
- O hidróxido de lítio (LiOH) é usado na fabricação de cerâmica, enquanto o hidróxido de magnésio (Mg(OH)2) é usado como antiácido ou laxante.
- O hidróxido de ferro é usado no processo de fertilização de plantas.
Nomenclaturas dos hidróxidos
Assim como para nomear outros tipos de compostos químicos, existem diferentes nomenclaturas para os hidróxidos:
- A nomenclatura Tradicional. São nomeados usando a palavra “hidróxido” seguida pelo nome do metal precedido ou terminado por um prefixo ou sufixo específico, dependendo do número de estados de oxidação que possui:
- Se o metal tiver apenas um estado de oxidação, seu nome receberá o sufixo “ico”. Por exemplo: hidróxido sódico/Na(OH).
- Se o metal tiver dois estados de oxidação, o sufixo “ico” será adicionado ao seu nome quando ele tiver o estado mais alto e o sufixo “oso” quando ele tiver o estado mais baixo. Por exemplo: hidróxido ferroso (II)/Fe(OH)2 e hidróxido férrico/Fe(OH)3.
- Se o metal tiver três estados de oxidação, seu nome será receberá o prefixo “hipo” e o sufixo “oso” quando tiver o estado de oxidação mais baixo, o sufixo “oso” para o estado seguinte e o sufixo “ico” quando tiver o estado mais alto. Por exemplo: hidróxido hipocromoso/Cr(OH)2, hidróxido cromoso/Cr(OH)3 e hidróxido crômico/Cr(OH)6.
- Se o metal tiver quatro estados de oxidação, seu nome receberá o prefixo “hipo” e o sufixo “oso” quando tiver o menor, o sufixo “oso” para o seguinte, o sufixo “ico” para o próximo e o prefixo “per” e o sufixo “ico” quando tiver o maior. Por exemplo: hidróxido hipovanadoso/V(OH)2, hidróxido vanadoso/V(OH)3, hidróxido vanádico/V(OH)4 e hidróxido pervanádico/V(OH)5.
- A nomenclatura de Stock. Usa a palavra hidróxido, mas, em vez de complementar com uma única palavra, usa a preposição “de” e, em seguida, o nome do metal, colocando a valência correspondente a cada composto entre parênteses. Por exemplo: hidróxido de ferro (II)/Fe(OH)2 e hidróxido de ferro (III)/Fe(OH)3.
- A nomenclatura Sistemática. São nomeados antepondo-se a palavra “hidróxido” os prefixos numéricos. Por exemplo: di-hidróxido de ferro/Fe(OH)2 y tri-hidróxido de ferro/Fe(OH)3.
Exemplos de hidróxidos
- Hidróxido de chumbo (II), Pb(OH)2, di-hidróxido de chumbo.
- Hidróxido de platina (IV), Pt(OH)4, tetra-hidróxido de platina.
- Hidróxido vanádico, V(OH)4, tetra-hidróxido de vanádio.
- Hidróxido ferroso, Fe(OH)2, di-hidróxido de ferro.
- Hidróxido de chumbo (IV), Pb(OH)4, tetra-hidróxido de chumbo.
- Hidróxido de prata, AgOH, hidróxido de prata.
- Hidróxido de cobalto, Co(OH)2, di-hidróxido de cobalto.
- Hidróxido de manganês, Mn(OH)3, tri-hidróxido de manganês.
- Hidróxido férrico, Fe(OH)3, tri-hidróxido de ferro.
- Hidróxido cúprico, Cu(OH)2, di-hidróxido de cobre.
- Hidróxido de alumínio, Al(OH)3, tri-hidróxido de alumínio.
- Hidróxido de sódio, NaOH, hidróxido de sódio.
- Hidróxido de estrôncio, Sr(OH)2, di-hidróxido de estrôncio.
- Hidróxido de magnésio, Mg(OH)2, di-hidróxido de magnésio.
- Hidróxido de amônio, NH4OH, hidróxido de amônio.
- Hidróxido de cádmio, Cd(OH)2, di-hidróxido de cádmio.
- Hidróxido vanadoso, V(OH)3, tri-hidróxido de vanádio.
- Hidróxido mercúrico, Hg(OH)2, di-hidróxido de mercúrio.
- Hidróxido cuproso, CuOH, hidróxido de cobre.
- Hidróxido de lítio, LiOH, hidróxido de lítio.
Às vezes, os hidróxidos têm nomes comuns que receberam por seus usos mais convencionais: o hidróxido de sódio também é chamado de soda cáustica, o hidróxido de potássio é chamado de potassa cáustica, o hidróxido de cálcio é chamado de água de cal ou cal apagada e o hidróxido de magnésio é chamado de leite de magnésia.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)