Índice
Há várias teorias para definir os ácidos e as bases, incluindo as teorias de Arrhenius, Brönsted-Lowry e Lewis.
- Segundo a teoria de Arrhenius. Um ácido é uma substância que, quando em solução aquosa, libera íons de hidrônio (H3O+) ou (H+), enquanto uma base é uma substância que, em solução aquosa, libera íons de hidroxila (OH–). Por exemplo: o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH) são um ácido e uma base de Arrhenius, respectivamente.
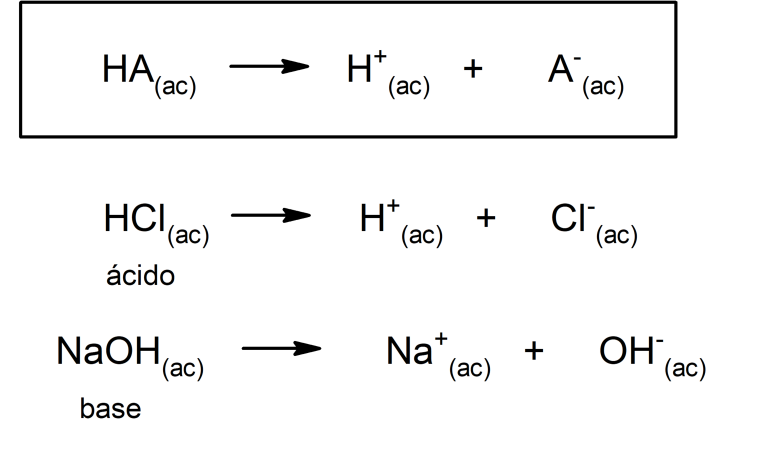
- Segundo a teoria de Brönsted-Lowry. Um ácido é uma espécie química que cede um íon hidrônio para outra espécie química (base de Brönsted-Lowry), enquanto uma base é uma espécie química que aceita um íon hidrônio de outra espécie química (ácido de Brönsted-Lowry). Por exemplo: o ácido acético (CH3COOH) e a amônia (NH3) são um ácido e uma base de Brönsted-Lowry, respectivamente.
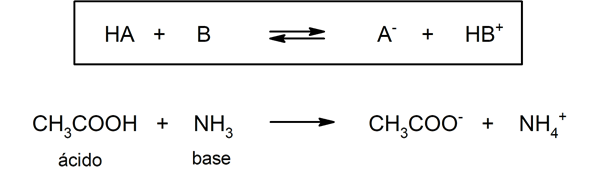
- Segundo a teoria de Lewis. Um ácido é uma substância química que aceita um par de elétrons de outra substância química (base de Lewis), enquanto uma base de Lewis é uma substância que cede um par de elétrons para outra substância (ácido de Lewis). Por exemplo: o trifluoreto de boro (BF3) e o íon fluoreto (F–) são um ácido e uma base de Lewis, respectivamente.
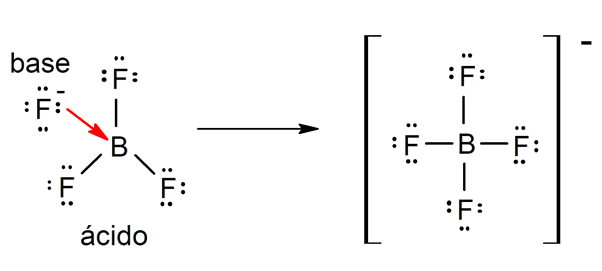
Os ácidos do tipo oxiácido geralmente são formados pela reação entre um óxido não metálico e água, enquanto os ácidos do tipo hidrácido são formados pela combinação de um não metal com hidrogênio em solução aquosa. Por exemplo: o ácido sulfúrico (H2SO4) é um oxiácido e o ácido clorídrico (HCl(ac)) é um hidrácido.
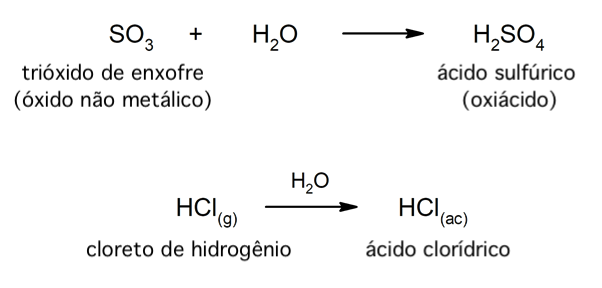
Por outro lado, as bases podem ser formadas como resultado da reação entre um óxido metálico e a água. Por exemplo: o hidróxido de magnésio (Mg(OH)2).
- Veja também: Substâncias neutras
Características gerais de ácidos e bases
Em geral, os ácidos têm sabor ácido e são corrosivos. As bases também são corrosivas, têm sabor amargo, são cáusticas quando em contato com a pele e dão a sensação de tocar um sabão. Por outro lado, as soluções de ácidos têm um pH menor que 7, enquanto as soluções de bases têm um pH maior que 7.
Força dos ácidos e das bases
A tendência de um ácido de se dissociar e diminuir o pH é geralmente chamada de “força desse ácido”. Um ácido é forte quando pode se dissociar completamente em uma solução aquosa e fraco quando sua dissociação ocorre parcialmente. São exemplos de ácidos fortes os ácidos perclórico (HClO4), sulfúrico (H2SO4), iodídrico (HI), bromídrico (HBr), clorídrico (HCl) e nítrico (HNO3). Por outro lado, os ácidos acético (CH3COOH), cítrico (C6H8O7) e benzoico (C6H5COOH) são fracos.
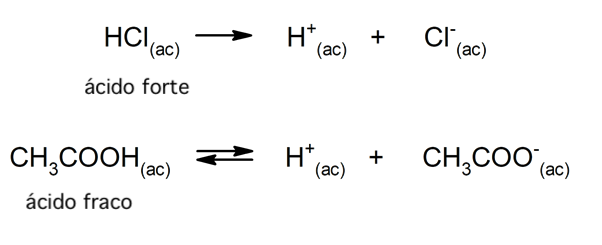
De forma semelhante, pode-se considerar que as bases fortes são aquelas que se dissociam completamente em uma solução aquosa, e as bases fracas quando a dissociação ocorre parcialmente. O hidróxido de potássio (KOH), o hidróxido de sódio (NaOH), o hidróxido de lítio (LiOH) e o hidróxido de magnésio (Mg(OH)2) são exemplos de bases fortes. Por outro lado, a amônia (NH3) é uma base fraca.
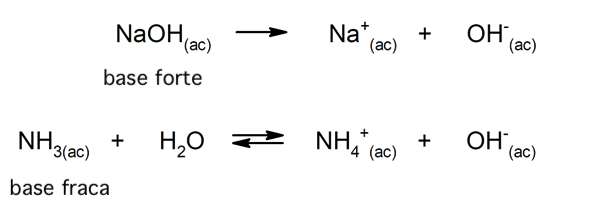
Como os sais se formam?
Os sais são compostos iônicos de complexidade diversa, abundantes na natureza, e geralmente são formados pela combinação de ácidos com bases em uma reação de neutralização, que gera a liberação de água. Também podem se formar como resultado da reação entre um metal e um ácido, um metal e um não metal ou a reação entre diferentes sais.
Os sais podem ser classificados como:
- Sais neutros ou binários. São compostos apenas por um metal e um não metal. Por exemplo: cloreto de sódio (NaCl) e brometo de potássio (KBr).
- Sais ácidos. Formam-se quando os hidrogênios de um oxiácido são parcialmente substituídos. Por exemplo: hidrogenocarbonato de sódio (NaHCO3), substitui-se um hidrogênio do ácido carbônico (H2CO3).
- Sais oxiácidos ou ternários. Formam-se quando todos os hidrogênios de um oxiácido são substituídos. Por exemplo: Sulfato de magnésio (MgSO4), todos os hidrogênios do ácido sulfúrico (H2SO4) são substituídos.
- Sais duplos. Formam-se quando dois hidrogênios de um oxiácido são substituídos por dois cátions diferentes. Por exemplo: sulfato duplo de sódio e potássio (KNaSO4), substitui-se dois hidrogênios do ácido sulfúrico (H2SO4).
- Sais básicos. São formados pelo íon hidróxido (OH–) e outros ânions. Por exemplo: cloreto de tri-hidróxido de cobre (II) (Cu2Cl(OH)3).
Distribuição e importância de ácidos e bases
Os ácidos são extremamente importantes tanto na indústria quanto na natureza. Por exemplo, o ácido clorídrico faz parte do nosso sistema digestivo e é necessário para que possamos degradar os nutrientes dos alimentos. O ácido desoxirribonucleico, mais conhecido como DNA, compõe os cromossomos, que é onde são codificadas as informações genéticas necessárias para que os seres vivos se multipliquem e se desenvolvam. O ácido bórico é um componente importante na indústria do vidro.
O carbonato de cálcio é um sal muito abundante em vários tipos de rochas calcárias. Sob ação de alta temperatura (900 °C), o carbonato de cálcio produz óxido de cálcio ou cal virgem. A adição de água à cal virgem produz hidróxido de cálcio, chamado de cal apagada, que é uma base. Estes materiais são usados na construção.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)