Índice
Os elementos químicos são um tipo de matéria que não pode ser reduzida ou decomposta em elementos mais simples por nenhuma reação ou processo químico. Por este motivo, pode-se dizer que um elemento é qualquer matéria composta de átomos de um mesmo tipo, ou seja, átomos que têm o mesmo número atômico (número igual de prótons), mesmo que tenham massas atômicas diferentes. Por exemplo: enxofre, boro, cromo, estanho.
A primeira definição de um elemento químico foi introduzida por Lavoisier em seu Traité Élémentaire de Chimie em 1789. No século XVIII, Lavoisier subdividiu as substâncias simples em quatro grupos:
- Elementos dos corpos
- Substâncias não metálicas oxidáveis e acidificáveis
- Substâncias metálicas oxidáveis e acidificáveis
- Substâncias salificáveis e terrosas
- Veja também: Compostos químicos
Tabela Periódica dos Elementos
Hoje em dia, são conhecidos 118 elementos químicos. Todos são coletados, classificados e organizados de acordo com muitas de suas propriedades em um esquema gráfico conhecido como Tabela Periódica dos Elementos, que foi originalmente criado pelo químico russo Dmitri Mendeleyev em 1869. A Tabela Periódica é composta de 18 grupos (colunas) e 7 períodos (linhas), nos quais estão dispostos os elementos químicos.
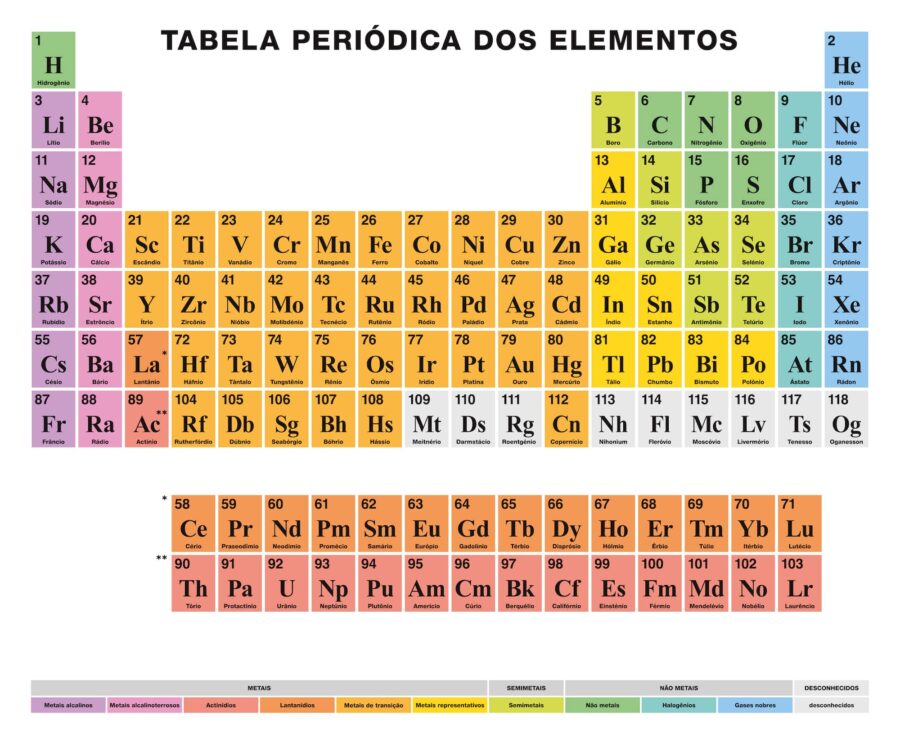
Os principais grupos que podem ser encontrados nesta tabela são:
Os metais alcalinos (Grupo 1), os metais alcalino-terrosos (Grupo 2), a família do escândio, que inclui os terrosos e actinídeos (Grupo 3), a família do titânio (Grupo 4), a família do vanádio (Grupo 5), a família do cromo (Grupo 6), a família do manganês (Grupo 7), a família do ferro (Grupo 8), a família do cobalto (Grupo 9), a família do níquel (Grupo 10), a família do cobre (Grupo 11), a família do zinco (Grupo 12), elementos terrosos (Grupo 13), elementos carbonáceos, nesse grupo está o carbono, que é a base da vida na Terra (Grupo 14), elementos nitrogenados (Grupo 15), elementos anfíbios, incluindo o oxigênio, que é essencial para a respiração dos seres vivos (Grupo 16), elementos halogenados (Grupo 17) e gases nobres (Grupo 18).
Muitos destes elementos têm isótopos estáveis ou radioativos, ou seja, o mesmo elemento químico, por exemplo, o hidrogênio (H), pode ter vários isótopos (1H, 2H, 3H). Isso significa que cada átomo de isótopo tem o mesmo número de prótons (o que implica que pertence ao mesmo elemento químico) e um número diferente de nêutrons.
Alguns isótopos não são estáveis (radioativos), ou seja, se desintegram dentro de um determinado tempo, emitindo certas partículas (nêutrons, fótons, partículas alfa, entre outras) e gerando outros isótopos estáveis ou radioativos. Os elementos químicos têm propriedades como pontos de ebulição e fusão, eletronegatividade, densidade e raio iônico, entre outras. Estas propriedades são importantes porque nos permitem prever seu comportamento, reatividade etc.
- Veja também: Tabela Periódica
Como os elementos são apresentados na Tabela Periódica?
Cada elemento químico é caracterizado na Tabela Periódica usando determinada simbologia. Primeiramente, no centro de cada quadro, seu símbolo universal é destacado em letras grandes, consistindo de uma ou duas letras (por convenção, se houver duas letras, a primeira é escrita em maiúscula e a seguinte em minúscula).
Acima e à esquerda se encontra o número atômico, escrito em tamanho pequeno, que é a quantidade de prótons que o respectivo elemento possui. Abaixo do símbolo do elemento está seu nome e, no canto superior esquerdo, sua massa atômica relativa. Além disso, a cor na qual o símbolo do elemento é representado significa seu estado de agregação (dependendo da representação usada em cada Tabela Periódica).
Os diferentes elementos têm raios atômicos variáveis e, à medida que o número de prótons no núcleo aumenta, maior é a atração que o núcleo exerce sobre os elétrons, de modo que o raio atômico tende a diminuir. Quando o raio atômico é pequeno, os elétrons no nível mais externo da nuvem são fortemente atraídos pelo núcleo e, portanto, não desistem facilmente. O oposto ocorre com os elementos com raios atômicos altos: cedem facilmente seus elétrons externos.
Assim, o raio atômico aumenta de cima para baixo à medida que percorremos os grupos da Tabela Periódica e diminui da esquerda para a direita à medida que percorremos seus períodos.
Exemplos de elementos químicos
| Elemento químico | Símbolo |
|---|---|
| Actínio | Ac |
| Alumínio | Al |
| Amerício | Am |
| Antimônio | Sb |
| Argônio | Ar |
| Arsênico | As |
| Ástato | At |
| Enxofre | S |
| Bário | Ba |
| Berílio | Be |
| Berquélio | Bk |
| Bismuto | Bi |
| Bóhrio | Bh |
| Boro | B |
| Bromo | Br |
| Cádmio | Cd |
| Cálcio | Ca |
| Califórnio | Cf |
| Carbono | C |
| Cério | Ce |
| Césio | Cs |
| Cloro | Cl |
| Cobalto | Co |
| Cobre | Cu |
| Cromo | Cr |
| Cúrio | Cm |
| Darmstádio | Ds |
| Disprósio | Dy |
| Dúbnio | Db |
| Einstênio | Es |
| Érbio | Er |
| Escândio | Sc |
| Estanho | Sn |
| Estrôncio | Sr |
| Európio | Eu |
| Férmio | Fm |
| Flúor | F |
| Fósforo | P |
| Frâncio | Fr |
| Gadolínio | Gd |
| Gálio | Ga |
| Germânio | Ge |
| Háfnio | Hf |
| Hássio | Hs |
| Hélio | He |
| Hidrogênio | H |
| Ferro | Fe |
| Hólmio | Ho |
| Índio | In |
| Iodo | I |
| Irídio | Ir |
| Itérbio | Yb |
| Ítrio | Y |
| Criptônio | Kr |
| Lantânio | La |
| Laurêncio | Lr |
| Lítio | Li |
| Lutécio | Lu |
| Magnésio | Mg |
| Manganês | Mn |
| Meitnério | Mt |
| Mendelévio | Md |
| Mercúrio | Hg |
| Molibdênio | Mo |
| Neodímio | Nd |
| Neônio | Ne |
| Neptúnio | Np |
| Nióbio | Nb |
| Níquel | Ni |
| Nitrogênio | N |
| Nobélio | No |
| Ouro | Au |
| Ósmio | Os |
| Oxigênio | O |
| Paládio | Pd |
| Prata | Ag |
| Platina | Pt |
| Chumbo | Pb |
| Plutônio | Pu |
| Polônio | Po |
| Potássio | K |
| Praseodímio | Pr |
| Promécio | Pm |
| Protactínio | Pa |
| Rádio | Ra |
| Radônio | Rn |
| Rêio | Re |
| Ródio | Rh |
| Rubídio | Rb |
| Rutênio | Ru |
| Rutherfórdio | Rf |
| Samário | Sm |
| Seabórgio | Sg |
| Selênio | Se |
| Silício | Si |
| Sódio | Na |
| Tálio | Tl |
| Tântalo | Ta |
| Tecnécio | Tc |
| Telúrio | Te |
| Térbio | Tb |
| Titânio | Ti |
| Tório | Th |
| Túlio | Tm |
| Copernício | Cn |
| Livermório | Lv |
| Roentgênio | Rg |
| Ununócio | Uuo |
| Ununpêntio | Uup |
| Fleróvio | Fl |
| Ununséptio | Uus |
| Unúntrio | Uut |
| Urânio | U |
| Vanádio | V |
| Tungstênio | W |
| Xenônio | Xe |
| Zinco | Zn |
| Zircônio | Zr |

Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)