Índice
Muitos compostos químicos são formados por moléculas, que, por sua vez, são formadas por átomos. Para formar as moléculas, os átomos são unidos através da formação de ligações químicas.
As ligações químicas não são todas iguais: elas dependem basicamente das características eletrônicas dos átomos envolvidos, de seus valores de eletronegatividade, entre outros fatores. Os tipos mais comuns de ligações são: ligações iônicas e ligações covalentes.
As ligações covalentes são formadas entre átomos não metálicos do mesmo elemento químico, entre átomos não metálicos de elementos diferentes com uma diferença de eletronegatividade menor ou igual a 1,7 e entre um não metal e o hidrogênio. Por exemplo: dicloreto, oxigênio molecular, água.
Uma ligação covalente se forma quando dois desses átomos compartilham os elétrons de seu último nível de energia para cumprir a regra do octeto, que afirma que os íons dos diferentes elementos químicos da Tabela Periódica tendem a completar seus últimos níveis de energia com 8 elétrons, de forma que as moléculas possam adquirir uma estabilidade semelhante à dos gases nobres.
Por isso, a maneira pela qual estas substâncias ou compostos químicos alcançam a estabilidade é compartilhando um par de elétrons (um de cada átomo). Desta forma, o par de elétrons compartilhado é comum a ambos os átomos e, ao mesmo tempo, os mantém unidos.
Por exemplo, no dióxido de carbono (CO2), cada oxigênio contribui com dois elétrons (vermelho) para a ligação com o carbono, enquanto o carbono contribui com dois elétrons (preto) para cada ligação com cada oxigênio. No composto formado, restam 8 elétrons em cada átomo e, desta forma, a regra do octeto é cumprida.
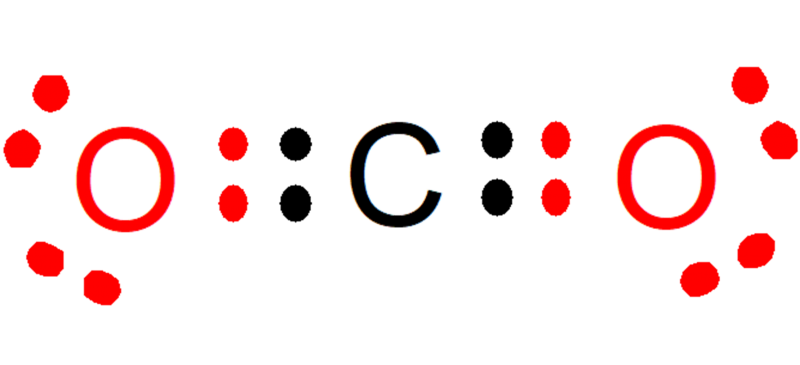
- Veja também: Ligação metálica
Tipos de ligações
Existem basicamente três tipos de ligações covalentes, embora seja importante esclarecer que nenhuma ligação é absolutamente covalente ou absolutamente iônica. Nesse sentido, podem ocorrer os seguintes tipos de ligações covalentes:
- Ligação covalente polar. Forma-se entre átomos de elementos químicos diferentes que têm uma diferença de eletronegatividade maior que 0,4. Os elétrons na ligação são mais atraídos para o átomo mais eletronegativo, deixando uma densidade de carga negativa nesse átomo e uma densidade de carga positiva no átomo menos eletronegativo. Devido à diferente distribuição de carga na molécula, é gerado um dipolo elétrico. Por exemplo: a ligação oxigênio-hidrogênio.
- Ligação covalente apolar. Forma-se entre átomos do mesmo elemento químico ou entre átomos com uma diferença de eletronegatividade insignificante. Por exemplo: a ligação entre carbono e hidrogênio.
- Ligação covalente coordenada ou dativa. É uma ligação covalente em que apenas um dos átomos que formam a ligação contribui com o par de elétrons compartilhado. Em geral, para que esse tipo de ligação se forme, um dos átomos envolvidos deve ter, pelo menos, um par de elétrons livres (como no caso do nitrogênio). Por exemplo: a ligação que se forma entre o nitrogênio e o hidrogênio no íon amônio (NH4+).
Substâncias compostas por moléculas covalentes
As substâncias que contêm moléculas covalentes podem ocorrer em qualquer estado da matéria (sólido, líquido ou gasoso) e geralmente são maus condutores de calor e eletricidade.
Existem substâncias covalentes moleculares e substâncias covalentes reticulares. As covalentes moleculares têm pontos de fusão e de ebulição baixos, são solúveis em solventes apolares (como benzeno ou tetracloreto de carbono) e, no estado sólido, são macias. As covalentes reticulares formam redes cristalinas, portanto, têm pontos de fusão e ebulição mais altos e são sólidos duros e insolúveis.
Exemplos de ligações covalentes
É possível citar vários exemplos de compostos ou substâncias que contenham ligações covalentes:
- Diflúor
- Dibromo
- Dicloro
- Diiodo
- Oxigênio molecular
- Água
- Amoníaco
- Dióxido de carbono
- Metano
- Propano
- Glicose
- Nitrogênio molecular
- Quartzo
- Parafina
- Diesel
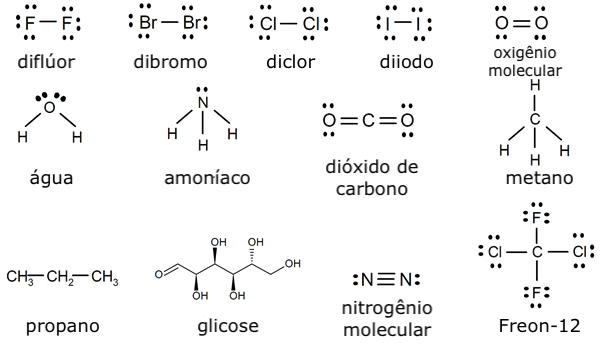
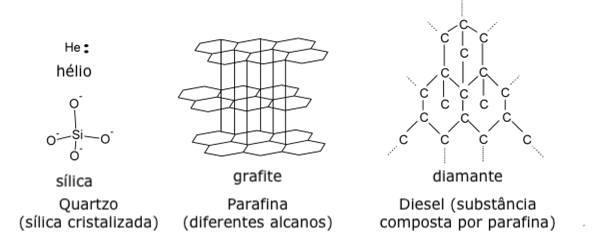
- Continue com: Ligações simples, duplas e triplas
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)