Índice
Em química, quando falamos de ligações simples, duplas e triplas, referimo-nos a três das formas conhecidas de ligação covalente, ou seja, de junções entre átomos a partir do compartimento de elétrons dos seus últimos níveis de energia. Existe também a ligação covalente, caso em que os elétrons compartilhados são fornecidos por apenas um dos átomos que formam a ligação.
As ligações covalentes ocorrem quando dois átomos se aproximam o suficiente para sobrepor parcialmente suas orbitais atômicas (região do espaço onde é provável encontrar um elétron ao redor do núcleo), compensando assim as forças de atração e repulsão simultâneas que surgem a partir de suas cargas elétricas (os elétrons, negativos se repelem entre si, mas as cargas positivas dos núcleos atômicos os atraem) e adquirindo uma estabilidade máxima que lhes permite constituir uma molécula.
Quando isso acontece, os pares de elétrons que orbitam as camadas mais externas de cada núcleo atômico se deslocam para o outro até tornar impossível determinar a que núcleo atômico pertenciam.
- Veja também: Matéria
Diferenças entre ligação covalente, ligação iônica e ligação metálica
- As ligações covalentes
As ligações covalentes se formam entre átomos de elementos não metálicos, quer sejam do mesmo elemento, quer de diferentes elementos. Eles também se formam entre um não metal e o hidrogênio. Para que se forme uma ligação deste tipo, a diferença de eletronegatividade entre os átomos da ligação deve ser inferior a 1,7.
Se os átomos que formam uma ligação covalente forem de diferentes não metais, um deles terá maior eletronegatividade que o outro. Por isso, os elétrons da ligação serão mais atraídos pelo átomo mais eletronegativo, ficando uma densidade de carga negativa sobre ele, enquanto que sobre o átomo menos eletronegativo ficará uma densidade de carga positiva, o que gera um dipolo (sistema de duas cargas elétricas de sinal contrário que estão muito perto) molecular. Nestes casos, forma-se uma ligação covalente polar, que constituem as moléculas polares que podem atrair outras moléculas do mesmo composto.
Por outro lado, se os átomos envolvidos na ligação covalente são do mesmo elemento não metálico, não se criarão dipolos, porque a diferença de eletronegatividade entre eles será zero e não haverá atração entre as moléculas do mesmo composto. A ligação deste tipo de moléculas é chamada de “ligação covalente apolar”.
- As ligações iônicas
As ligações iônicas se formam entre átomos com uma elevada diferença de eletronegatividade. Ocorre uma transferência de, pelo menos, um elétron do átomo menos eletronegativo (formando um catião (+)) ao mais eletronegativo (formando um anião (-)). A ligação é finalmente formada por atração eletrostática entre os dois íons de cargas opostas.
- As ligações metálicas
As ligações metálicas se formam entre átomos de elementos metálicos. Os átomos destes tipos de elementos se encontram muito unidos entre si, e os elétrons de valência formam uma “nuvem” à sua volta.
Tipos de ligação covalente
Dependendo da quantidade de pares de elétrons compartilhados entre os átomos que formam a ligação, as ligações covalentes serão simples (um par), duplas (dois pares) ou triplas (três pares). Cada um deles é geralmente representado por uma, duas ou três linhas entre os símbolos de cada átomo:
- H – H, a molécula de H2 através de uma ligação simples.
- O = O, a molécula de O2 através de uma ligação dupla.
- N Ξ N, a molécula de N2 através de uma ligação tripla.
A quantidade de ligações simples, duplas ou triplas que um átomo poderá formar depende diretamente de sua valência, ou seja, da quantidade de elétrons que possa compartilhar de sua camada mais externa.
Além disso, dependendo do grau de complexidade da ligação, a molécula tem mais ou menos mobilidade (menos mobilidade quanto mais complexa for a ligação), já que a distância entre os átomos é menor e é mais difícil romper a ligação, ou seja, é preciso aplicar mais energia para conseguir a sua ruptura.
Exemplos de ligação covalente simples
- Molécula de hidrogênio (H2)
- Molécula de cloro (Cl2)
- Molécula de fluoreto de hidrogênio (HF)
- Molécula de água (H2O)
- Molécula de ácido clorídrico (HCl)
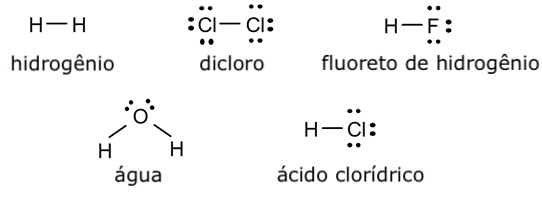
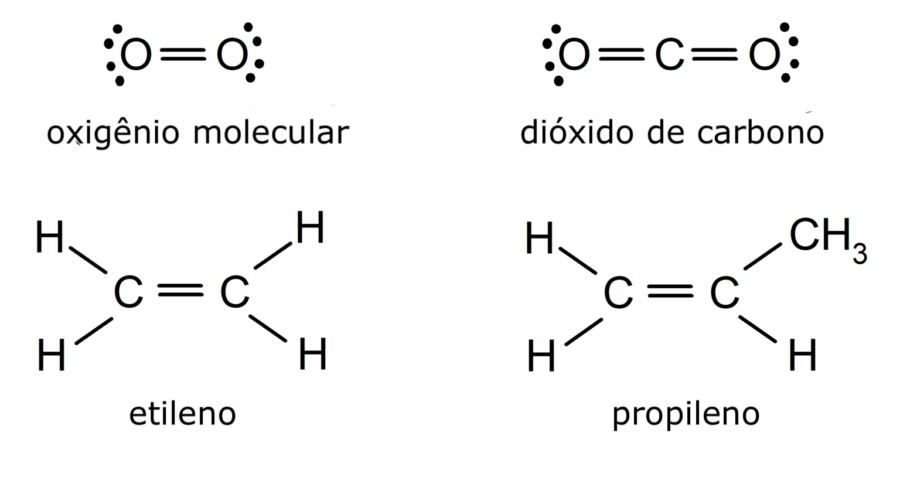
Exemplos de ligação covalente dupla
- Molécula de oxigênio (O2)
- Molécula de dióxido de carbono (CO2)
- Molécula de etileno (C2H4)
- Molécula de propileno (C3H6)
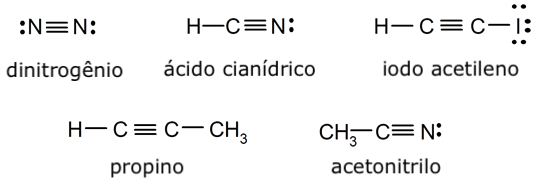
Exemplos de ligação covalente tripla
- Molécula de nitrógeno (N2)
- Molécula de ácido cianhídrico (HCN)
- Molécula de iodo acetileno (HC2I)
- Molécula de propino (C3H4)
- Molécula de acetonitrilo (CH3CN)
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)