As misturas de substâncias gasosas são algumas das mais fáceis de obter, pois é bastante viável misturar substâncias que estão nesse estado de agregação. Por exemplo: mistura de neônio, argônio e xenônio, inseticida em spray, ar e hélio.
Praticamente todos os gases podem ser combinados sem limites, desde que, é claro, estejam sujeitos a determinados aspectos químicos, físicos e, principalmente, de segurança para o usuário que os manuseia. Assim, como os diferentes tipos de misturas que se estabelecem entre substâncias, as misturas de gases também têm propriedades que lhes são únicas.
O estudo das misturas gasosas costuma ser tão útil quanto o estudo dos gases em seu estado puro: o mesmo conhecimento sobre o ar presente na atmosfera seria impossível se não fosse o conhecimento das proporções e do comportamento dos gases misturados.
Assim, é imprescindível conhecer algumas características das misturas de gases, como a propriedade da pressão parcial (aquela exercida por cada um dos gases da mistura) e a fração molar (a relação entre o número de moles de um componente gasoso e o total da mistura gasosa). Os moles expressam a quantidade de gás presente na mistura.
A Lei de Dalton afirma que a pressão total de uma mistura de gases é igual à soma das pressões parciais de cada um dos gases individuais que se encontram nela (isso está sujeito ao fato de os gases não reagirem entre si). A pressão parcial é entendida aqui como aquela que seria exercida por cada um dos gases se eles estivessem sozinhos no mesmo recipiente e sob as mesmas condições de temperatura. Assim:
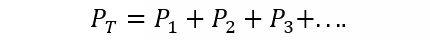
Onde PT é a pressão total e P1, P2 e P3 são as pressões parciais dos gases hipotéticos 1, 2 e 3 na mistura gasosa.
Usando a Lei de Dalton, foi desenvolvida uma expressão para calcular a pressão parcial de um gás em uma mistura gasosa se soubermos sua pressão total e fração molar.
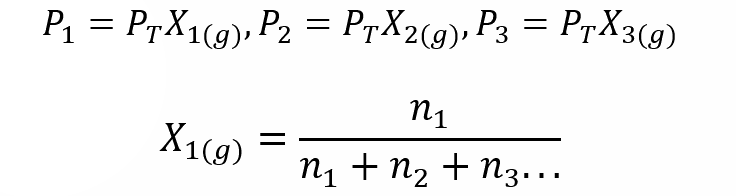
Onde X1, X2 e X3 são as frações molares dos gases hipotéticos 1, 2 e 3 na mistura de gases, e n1, n2 e n3 são as quantidades de substância de cada um desses gases na mesma mistura.
Uma das principais propriedades dos componentes das misturas é a concentração, que pode ser expressa em diferentes unidades. No caso das misturas de gases, a concentração de seus componentes pode ser expressa em ppm (partes por milhão), uma unidade referente ao seu volume. Em outras palavras, uma determinada quantidade de ppm de um componente em uma mistura de gases é a razão entre o volume desta determinada quantidade e o volume de cada milhão de unidades da mistura.
É importante observar que o ppm de um gás depende da temperatura e da pressão do gás. Por isso, para calcular o ppm de um gás, geralmente são usadas as condições de pressão e temperatura normais (CNPT), que dão 0 grau Celsius de temperatura e 1013 hectopascais (1 bar) de pressão como estado normal. Se estas condições não forem usadas, deve-se especificar as que serão usadas.
- Veja também: Soluções
Exemplos de misturas de gases
A lista a seguir contém misturas de gases, explicando os elementos que aparecem na mistura:
- Ar (mistura de 21% de oxigênio e 79% de nitrogênio, além de outros gases em pequenas proporções).
- Cronigon (mistura de 99% de argônio e 1% de oxigênio)
- Trimix (mistura de oxigênio, nitrogênio e hélio)
- Mistura de neônio, argônio e xenônio
- Mistura de 85% de metano, 9% de etano, 4% de propano e 2% de butano.
- Hexafluoreto de enxofre e ar
- Inseticida em aerossol
- Ar e hélio
- Nitrox (mistura de ar, enriquecida com oxigênio e nitrogênio)
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)