Índice
A química distingue entre dois tipos de moléculas que compõem a matéria, de acordo com o tipo de átomos em que estão baseadas suas estruturas: moléculas orgânicas e moléculas inorgânicas.
A diferença fundamental entre os dois tipos de moléculas (e entre as substâncias que delas se compõem) se baseiam sobretudo na presença de átomos de carbono (C) formando ligações covalentes com outros átomos de carbono e com átomos de hidrogênio (H), bem como com outros elementos frequentes como oxigênio (O), nitrogênio (N), enxofre (S), fósforo (P) e alguns metais. As moléculas que têm esta estrutura baseada no carbono são conhecidas como moléculas orgânicas e são essenciais para a vida.
Por outro lado, as moléculas cuja estrutura não é baseada no carbono (não significa que não possam conter carbono) são denominadas inorgânicas.
- Veja também: Macromoléculas
As moléculas orgânicas
Uma das principais características da maioria das substâncias orgânicas é a sua combustibilidade, ou seja, a sua capacidade de queimar e perder ou alterar a sua estrutura original, como é o caso dos hidrocarbonetos que integram os combustíveis fósseis. Além disso, algumas são solúveis em solventes orgânicos como a gasolina, enquanto outras são solúveis em água. Geralmente têm pontos de fusão e ebulição mais baixos que os compostos inorgânicos.
Existem dois tipos de substâncias orgânicas, de acordo com a sua origem:
- Moléculas orgânicas naturais. Aquelas que são sintetizadas pelos seres vivos e que constituem os blocos fundamentais para o funcionamento e crescimento de seus corpos. São conhecidas como biomoléculas. Por exemplo: glicose, colesterol, colágeno. Existem também moléculas orgânicas naturais que fazem parte do petróleo, originadas há milhares de anos.
- Moléculas orgânicas artificiais. Devem sua origem à mão do homem, já que não existem na natureza como tais, assim que são sintetizadas em laboratórios e indústrias. É o caso dos plásticos, por exemplo.
Cabe observar que, em linhas gerais, existem vários tipos de moléculas orgânicas integrando o corpo dos seres vivos: proteínas, lipídios, carboidratos, nucleotídeos e moléculas pequenas.
Exemplos de moléculas orgânicas
- Glicose (C6H12O6). Um dos principais açúcares (carboidratos) que servem de base à construção dos diversos polímeros orgânicos (de reserva energética ou de função estrutural). Do processamento bioquímico, os animais obtêm a sua energia vital (respiração).
- Celulose (C6H10O5). É um biopolímero indispensável para a vida vegetal e a biomolécula mais abundante do planeta. Sem ela, seria impossível construir a parede celular das células vegetais, por isso se trata de uma molécula de funções estruturais insubstituíveis.
- Frutose (C6H12O6). É um monossacarídeo presente nas frutas, vegetais e mel, possui a mesma fórmula, mas diferente estrutura que a glicose (é o seu isômero). Com esta última, forma sacarose ou açúcar de mesa.
- Ácido fórmico (CH2O2). É o ácido orgânico mais simples que existe, utilizado pelas formigas e abelhas como substância irritante para seus mecanismos de defesa. Também é segregado pelas urtigas e outras plantas urticantes, e faz parte dos compostos que integram o mel.
- Metano (CH4). É o hidrocarboneto alcano mais simples de todos, cuja forma gasosa é incolor, inodora e insolúvel em água. É o componente majoritário do gás natural e um produto frequente dos processos de digestão animal.
- Colágeno. É uma proteína necessária para a formação de fibras, comum a todos os animais e que compõem os ossos, tendões e pele, o que soma 25% das proteínas totais do corpo dos mamíferos.
- Benzeno (C6H6). É um hidrocarboneto aromático composto por seis átomos de carbono localizados nos vértices de um hexágono perfeito, que estão unidos por ligação covalente típica e também por uma nuvem eletrônica de tipo pi (). É um líquido incolor de aroma doce altamente inflamável.
- DNA (ácido desoxirribonucleico). É um polímero de nucleótidos e é a molécula básica do material genético dos seres vivos, cujas instruções permitem a replicação de todo o material necessário para a sua criação, funcionamento e eventual reprodução. Sem o DNA seria impossível a transmissão da informação hereditária.
- RNA (ácido ribonucleico). É a outra molécula indispensável na síntese das proteínas e substâncias que integram os seres vivos. Formada por uma cadeia de ribonucleotídeos, se apoia no DNA para a execução e reprodução do código genético, essencial na divisão celular e na constituição de toda forma de vida complexa.
- Colesterol. É um lipídio presente nos tecidos corporais e plasma sanguíneo dos vertebrados, essencial na constituição da membrana plasmática das células, apesar de que seus níveis muito elevados no sangue podem levar a problemas na circulação sanguínea.

As moléculas inorgânicas
As moléculas inorgânicas não têm como base o carbono, mas sim outros variados elementos. Formam-se como resultado de diferentes processos físicos e químicos como: a fusão, a eletrólise e a ação da energia solar. Por exemplo: ozônio, óxido de cálcio, hélio.
A linha divisória entre as moléculas orgânicas e inorgânicas têm sido frequentemente contestada e considerada arbitrária, uma vez que muitas substâncias inorgânicas contêm carbono e hidrogênio. No entanto, a regra estabelecida sugere que todas as moléculas orgânicas são baseadas em carbono, mas nem todas as moléculas com carbono são orgânicas.
- Veja também: Matéria orgânica e inorgânica
Exemplos de moléculas inorgânicas

- Monóxido de carbono (CO). Apesar de consistir em apenas um átomo de carbono e outro de oxigênio, trata-se de uma molécula inorgânica e de um poluente ambiental extremamente tóxico, ou seja, de presença incompatível com a maioria dos seres vivos conhecidos.
- A água (H2O). Embora seja essencial para a vida e talvez das moléculas mais conhecidas e abundantes, a água é inorgânica. É capaz de conter seres vivos no seu interior, como os peixes nos mares, lagos e rios. Por outro lado, os seres vivos a contêm em seu interior, mas não é propriamente uma biomolécula.
- Amônia (NH3). É um gás incolor de odor repulsivo, cuja presença nos organismos vivos é tóxica e letal, apesar de ser um subproduto de muitos processos biológicos. Por isso é excretado de seus corpos, através da urina, por exemplo.
- Cloreto de sódio (NaCl). É a molécula do sal comum, solúvel em água e presente nos organismos vivos que a ingerem através da sua dieta e descartam o excesso mediante diversos processos metabólicos.
- Óxido de cálcio (CaO). Conhecido como “cal” ou “cal viva”, provém de rochas calcárias e tem sido muito empregado na história em trabalhos de construção ou na fabricação do fogo grego.
- Ozônio(O3). É uma substância muito presente na parte elevada da atmosfera (na camada de ozônio), cujas condições especiais lhe permitem existir, pois normalmente as suas ligações decaem e recuperam a forma diatômica (O2). É utilizado para purificar a água, mas em grandes quantidades pode ser irritante e um pouco tóxico.
- Óxido férrico (Fe2O3). O óxido de ferro comum é um metal muito empregado em diferentes indústrias humanas. É avermelhado e não é um bom condutor de eletricidade. É estável ao calor e facilmente dissolvido em ácidos, resultando em outros compostos.
- Hélio (He). É um gás nobre (junto ao argônio, neônio, xenônio e criptônio) de baixíssima ou nula reatividade química, que existe em sua forma monoatômica.
- Dióxido de carbono (CO2). É a molécula resultante da respiração dos seres vivos aeróbios, que a expulsam. E é necessária para a fotossíntese dos vegetais, que a tiram do ar. É uma substância vital, mas não faz parte das moléculas orgânicas, apesar de ter um átomo de carbono.
- Hidróxido de sódio (NaOH). Conhecido como “soda cáustica”, é encontrado na forma de cristais brancos sem cheiro. É uma base forte, ou seja, uma substância altamente dessecante, que reage exotermicamente (gerando calor) quando dissolvida em água. Em contato com substâncias orgânicas gera danos por corrosão.
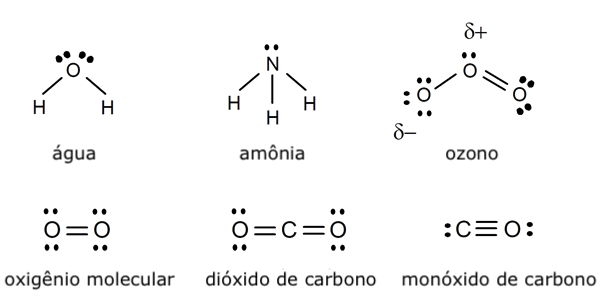
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)