Índice
Os oxissais, sais oxigenados ou sais ternários são compostos resultantes da união de um cátion de um elemento metálico (às vezes não metálico), um elemento não metálico e o oxigênio. São o produto da substituição dos átomos de hidrogênio de um oxiácido. Por exemplo: nitrato de sódio, clorato de potássio, sulfato de amônio.
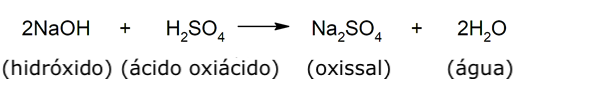
Como a maioria dos sais, quase todos os oxissais também são solúveis em água e, quando dissolvidos em água, são bons condutores de eletricidade. Por outro lado, possuem um ponto de fusão alto e baixa dureza e compressibilidade.
Este tipo de composto químico apresenta uma ampla gama de usos práticos, industriais e farmacológicos.Trata-se de substâncias comumente produzidas e com alta demanda, além de serem abundantes no estado natural: a crosta terrestre é composta em grande parte por esses sais.
- Veja também: Compostos orgânicos e inorgânicos
Exemplos de oxissais
- Nitrato de sódio (NaNO3). Usado no tratamento do botulismo, uma condição causada por neurotoxinas bacterianas.
- Nitrito de sódio (NaNO2). Um sal típico usado na indústria alimentícia como conservante e fixador de cor.
- Nitrato de potássio (KNO3). Costuma ser usado como fertilizante, seja diretamente ou como matéria-prima para fertilizantes líquidos e multinutrientes.
- Sulfato de cobre (I) (Cu2SO4). Tem aplicações como limpador de piscinas, como suplemento fotossintético em todos os tipos de culturas vegetais e na indústria agronômica.
- Clorato de potássio (KCIO3). Com esta substância, são fabricadas as cabeças dos fósforos e é amplamente utilizada no setor pirotécnico devido à sua alta liberação de energia quando entra em contato com substâncias como açúcar ou enxofre e é submetida a atrito.
- Sulfato de sódio (Na2SO4). Solúvel em água e glicerina, é usado como dessecante na indústria química e em laboratórios e na fabricação de vidro, detergentes e celulose para papel.
- Sulfato de bário (BaSO4). Está presente em sua forma mineral (barita) extremamente comum e é empregado na produção de água oxigenada, na indústria da borracha e em pigmentos para tintas.Também é utilizado para revestir salas de raios X, pois é opaco a este tipo de radiação.
- Carbonato de cálcio (CaCO3). É um potente suplemento de cálcio, essencial na produção de vidro e cimento.Também é usado como antiácido e agente adsorvente na medicina. É muito abundante na natureza: as conchas dos crustáceos e os esqueletos de muitos organismos são feitos deste sal.
- Sulfato de cálcio (CaSO4). É usado como dessecante e como coagulante na preparação de tofu. É um produto químico comum na maioria dos laboratórios.
- Fosfatos de sódio (NaH2PO4, Na2HPO4, Na3PO4 y otros). São três tipos de sais empregados na indústria alimentícia como estabilizadores ou aditivos anti-secagem, assim como na indústria farmacêutica contra a formação de cálculos renais e como laxantes.
- Silicato de cobalto (CoSiO3). É utilizado em pigmentos para a indústria de tintas artísticas, especificamente na produção de azul-cobalto.
- Hipoclorito de cálcio (Ca[ClO]2). É altamente eficaz como bactericida e desinfetante e, portanto, é usado no tratamento de águas residuais e como alvejante.
- Hipoclorito de sódio (NaClO). Comumente conhecido como água sanitária, é uma substância fortemente oxidante, estável apenas em pH básico, usada como desinfetante e alvejante, altamente tóxica, especialmente em combinação com outros ácidos.
- Sulfato de ferro (II) ou ferroso (FeSO4). De cor azul a verde, usado como purificador de água, corante (índigo) e tratamento médico para anemia por deficiência de ferro, ou para enriquecer alimentos com ferro.
- Sulfato de ferro (III) ou vitríolo de marte (Fe2[SO4]3). Um sal amarelo sólido, solúvel em água em temperatura ambiente, usado como coagulante em resíduos industriais, pigmento corante e medicamento adstringente em pequenas doses.Também é útil na sedimentação de resíduos em tanques de água sem depurar.
- Bromato de sódio (NaBrO3). Um oxidante forte de toxicidade moderada, é usado em tinturas de cabelo permanentes e como solvente para ouro na mineração. Foi usado na indústria de panificação como um melhorador até sua recente proibição em muitos países desde a década de 1970.
- Fosfato de magnésio (Mg3[PO4]2). O sal contra cãibras e espasmos musculares é um composto médico amplamente utilizado contra dores musculares, menstruais ou até mesmo intestinais, bem como neuralgia dental e contraturas.
- Sulfato de alumínio (Al2[SO4]3). É sólido e branco (tipo A) ou marrom (tipo B), amplamente utilizado na indústria de papel, pigmentos têxteis e, até 2005, era comumente usado em antitranspirantes, antes de os órgãos internacionais desaconselharem seu uso.
- Bromato de potássio (KBrO3). Sal iônico com cristais brancos, é um agente oxidante que foi usado por muitos anos na fabricação de pães, pois aumentava o volume da massa, mas sua permanência residual no alimento, em casos de uso excessivo ou cozimento insuficiente, pode ser tóxica. Foi usado em outras indústrias alimentícias até ser proibido na maior parte do mundo (exceto nos Estados Unidos) na década de 1990.
- Sulfato de amônio (NH4)2SO4. Amplamente usado em química de laboratório e na indústria agrícola como fertilizante de ação direta ao solo, geralmente obtido como produto residual na fabricação de nylon.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)