O pH é uma sigla que significa potencial de hidrogênio e funciona como uma medida da acidez ou alcalinidade de uma solução, uma vez que indica a concentração de íons de hidrogênio ou de hidrônio ([H3O+] ou [H+]) presentes em uma solução.
Está provado que existe uma correlação completa entre a concentração de íons de hidrogênio e o nível de acidez de uma substância: os ácidos fortes têm elevadas concentrações de íons de hidrogênio, enquanto os ácidos fracos têm baixas concentrações.
O bioquímico Sørensen propôs em 1909 que matematicamente o pH se define como o negativo do logaritmo decimal da atividade (concentração efetiva) de íons hidrogênio em uma solução. Se a solução for diluída, é possível utilizar a concentração molar em vez da atividade.
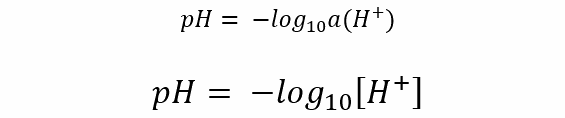
Em que a(H+) e [H+] são a atividade e a concentração molar de íons de hidrogênio, respectivamente.
A escala pH é estabelecida entre o número 0 e 14: 0 é a extremidade ácida, enquanto 14 é a extremidade alcalina. O número 7, o intermediário, é o que se conhece por pH neutro.
- Veja também: Subtâncias puras e misturas
Como é medido o pH?

Para a medição do pH, utiliza-se frequentemente um produto químico denominado indicador de pH (também chamado de indicador ácido-base). Um dos indicadores mais conhecidos é o papel de tornassol, um papel com substâncias aderentes que são sensíveis às mudanças de pH e fazem com que o mesmo mude sua cor dependendo da acidez da solução na qual se mergulha.
As substâncias mais ácidas farão com que o papel se torne rosa, enquanto as mais básicas farão com que fique azul. Alguns dos papéis deste tipo têm sinalização dos níveis de cores que adquirem segundo o pH, para que quem o utilize possa decodificar o nível de potencial de hidrogênio simplesmente com a cor.
No entanto, o papel tornassol não é completamente preciso e, nestes casos, utiliza-se um aparelho conhecido como pHmetro. Trata-se de um instrumento de medição constituído geralmente por um eletrodo de prata/cloreto de prata (Ag/AgCl) e um eletrodo de vidro sensível a íons de hidrogênio. Assim, o pH pode ser medido pela variação do potencial entre os dois eletrodos quando imersos em uma solução.
Exemplos do pH de certas substâncias

| Suco de limão (pH 2) | Suco de laranja (pH 4) |
| Suco gástrico (pH 1) | Cerveja (pH 5) |
| Detergente (pH 10,5) | Amônia (pH 12) |
| Água com sabão (pH 9) | Alvejante (pH 13) |
| Água de mar (pH 8) | Refrigerante de cola (pH 3) |
| Água de cal (pH 11) | Ácido clorídrico (pH 0) |
| Leite de magnésia (pH 10) | Bateria (pH 1) |
| Pele humana (pH 5,5) | Hidróxido de sódio (pH 14) |
| Leite (pH 6) | Água pura (pH 7) |
| Vinagre (pH 3) | Sangue (pH 7) |
Como manter o pH constante?
Por vezes, o procedimento laboratorial necessita preparar e guardar uma solução com pH constante. A preservação desta solução é mais difícil do que a sua preparação, pois se entrar em contato com o ar, absorverá dióxido de carbono e se tornará mais ácida, ao mesmo tempo que, se conservado em um recipiente de vidro, torna-se mais alcalina devido às impurezas removidas do vidro.
As soluções buffer são aquelas capazes de manter o seu pH estável em uma determinada gama de pH em comparação com a adição de quantidades relativamente pequenas de ácidos ou bases fortes.
As preparações deste tipo são realizadas com um ácido fraco, por exemplo, ácido acético (CH3COOH) e um sal do mesmo ácido, por exemplo, acetato de sódio (C2H3O2Na), ou utilizando uma base fraca, por exemplo, amônia (NH3) e um sal da mesma base, por exemplo, cloreto de amônia (NH4Cl). Mesmo em organismos vivos as células devem manter um pH quase constante, para a ação enzimática e metabólica.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)