Chama-se reação química o processo pelo qual uma ou mais substâncias químicas (denominadas “reagentes”) são transformadas e dão origem a outras substâncias químicas (denominadas “produtos”). Assim, para que os reagentes gerem os produtos mediante uma reação química, é necessário que ocorra um rearranjo de átomos e moléculas no qual ocorra uma troca de energia. Por exemplo: combustão, oxidação, reações ácido-base.
Os compostos químicos têm energia química nas ligações entre seus átomos constituintes. As reações químicas geralmente são expressas através de equações, em que os reagentes são indicados à esquerda e à direita os produtos, com uma seta apontando para a direita se a reação for irreversível ou uma seta apontando para frente e para trás se for uma reação reversível.
Quando se indica as quantidades ou proporções em que reagem os reagentes e se obtêm os produtos, falamos de reações estequiométricas.
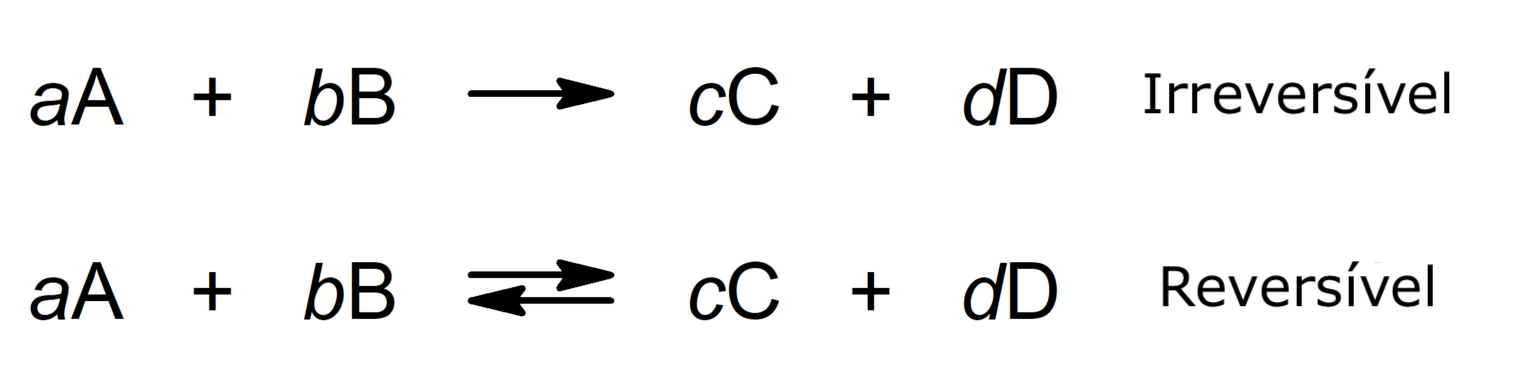
Onde:
- A e B são os reagentes.
- C e D são os produtos.
- a, b, c, d são os coeficientes estequiométricos (número de moléculas ou átomos de um determinado tipo que participam de uma equação química).
As reações químicas podem ser classificadas segundo o tipo de energia que liberam ou absorvem. Neste sentido, podem ser exotérmicas ou endotérmicas (se liberarem ou absorverem calor), exoluminosas ou endoluminosas (se liberarem ou absorverem luz), exoelétricas ou endoelétricas (se produzirem ou exigirem eletricidade).
- Veja também: Propriedades físicas e químicas da matéria
As leis das reações químicas
As reações químicas são regidas por leis. A mais importante é a lei da conservação da massa ou lei de Lavoisier, formulada por esse químico em 1774, que postula que em toda reação química a massa dos reagentes é igual à massa dos produtos.
Foi Dalton quem completou a explicação dessa lei alguns anos mais tarde, quando indicou que, em uma reação química, o número de átomos não varia ao comparar os reagentes com os produtos, somente muda sua organização, portanto, a massa é conservada.
Outro parâmetro importante nas reações químicas é sua velocidade de reação, pois nem todas levam o mesmo tempo para ocorrer. A velocidade de reação se define como a quantidade de produto que aparece por unidade de tempo ou a quantidade de reagente que desaparece por unidade de tempo.
Apesar de cada reação ter uma velocidade diferente, alguns fatores podem fazer com que ela tenda a aumentar ou diminuir: a superfície de contato entre as partículas reagentes e a temperatura são alguns deles.
Os catalisadores são substâncias que aumentam a velocidade de uma reação, sem alterar sua estrutura. Com frequência, alguns metais desempenham esse papel.
Exemplos de reações químicas
As reações químicas ocorrem continuamente na natureza, no corpo humano, nas fábricas, nas estações de tratamento de efluentes, etc. Alguns exemplos são:
- Combustão

- Substituição

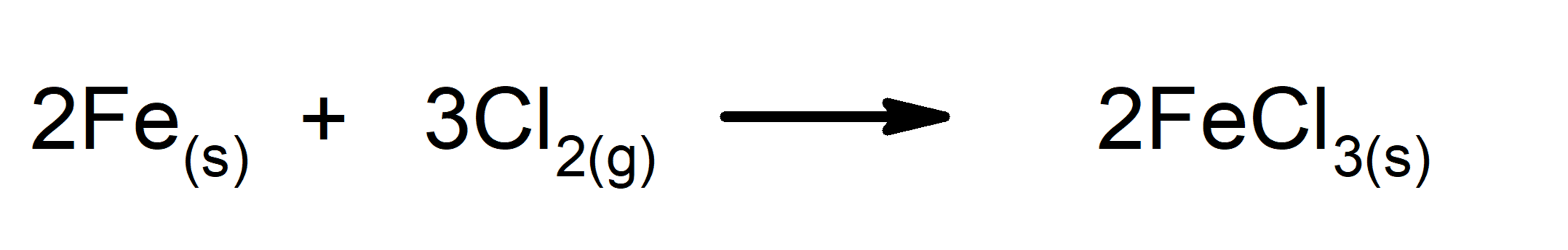
- Adição

- Eliminação

- Oxidação

- Redução

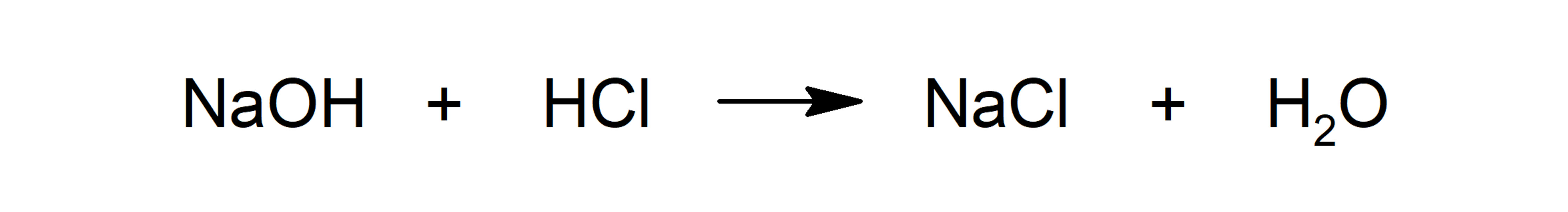
- Reações ácido-base

- Oxigenação

- Transaminação

- Cloração

- Carbonilação

- Nitrosilação. É uma reação em que um grupo nitrosil é ligado a uma proteína após ter sido sintetizada pelos ribossomos.

- Peroxidação

- Fotólise da água

- Sulfatação

- Carbonatação

- Ozonização. É uma reação alternativa à cloração para descontaminar a água.
- Esterificação

- Hidrogenação de alcenos

- Acetilação

Continue com:
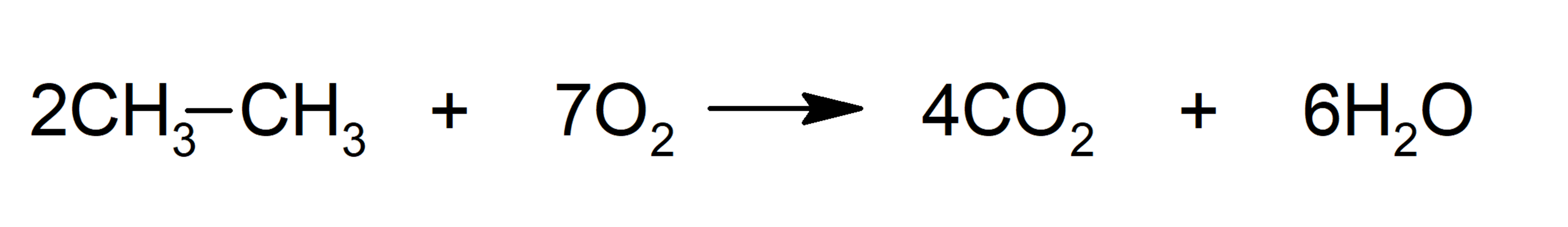
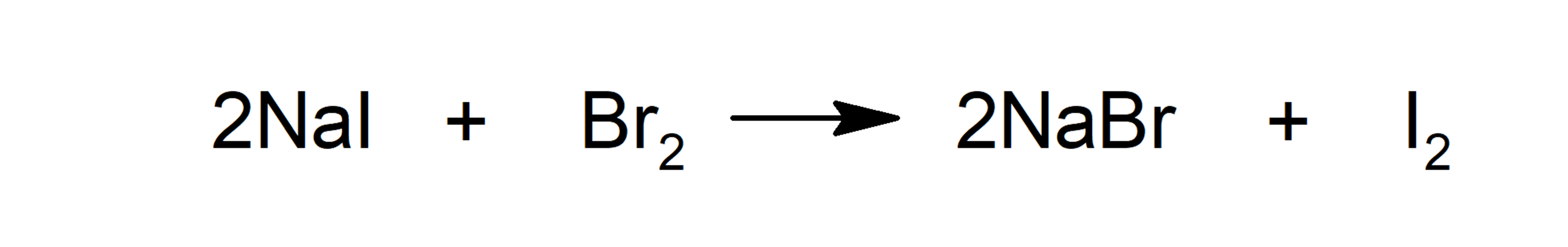
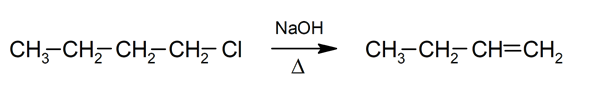
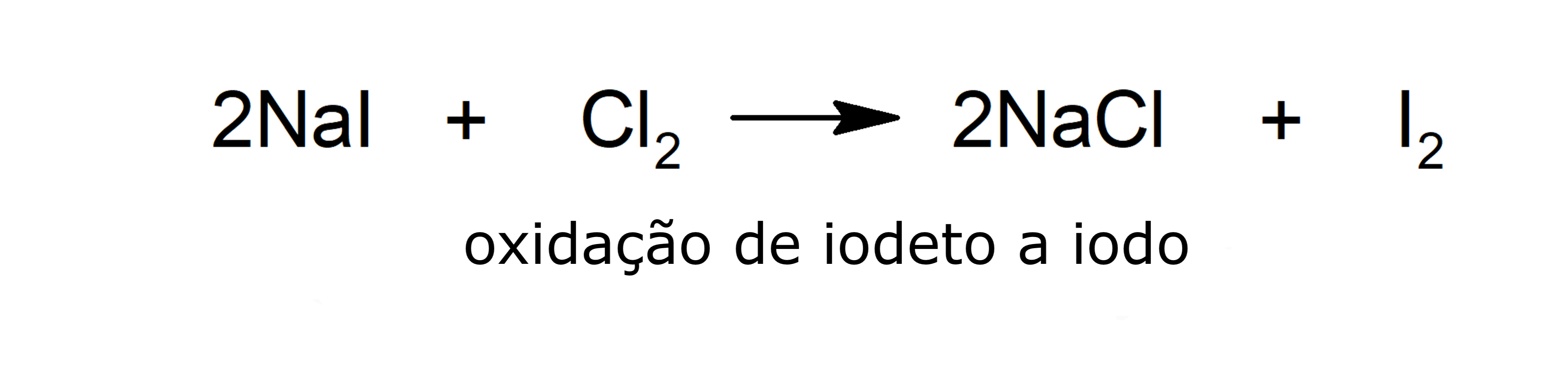
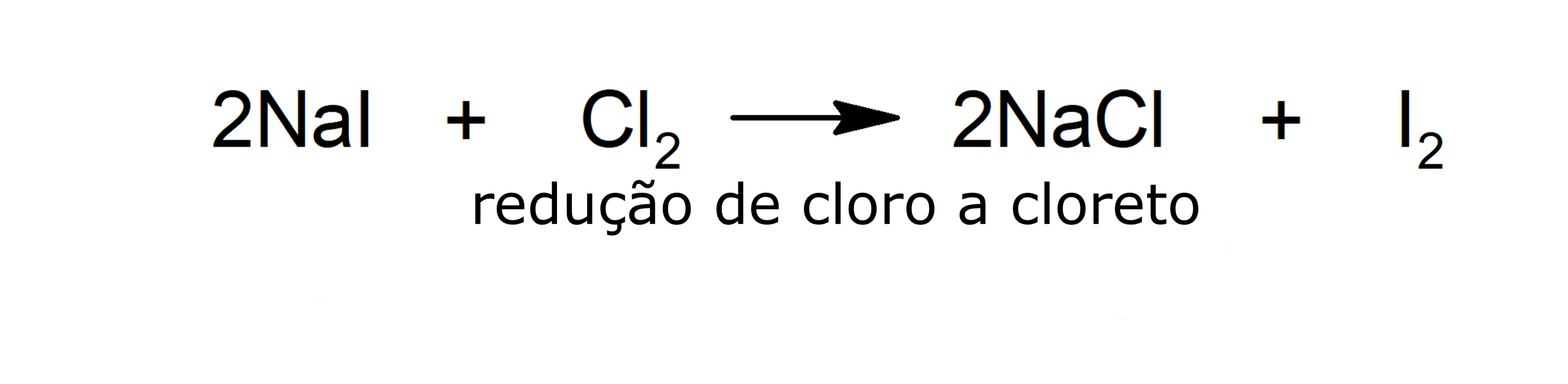

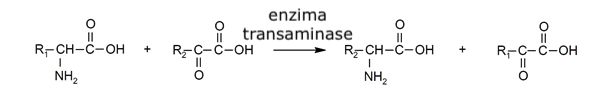
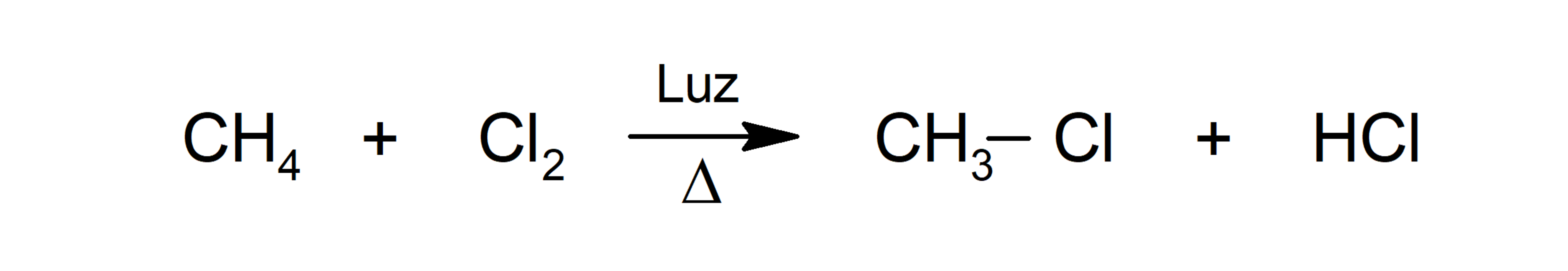


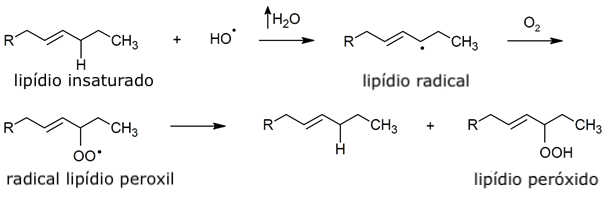
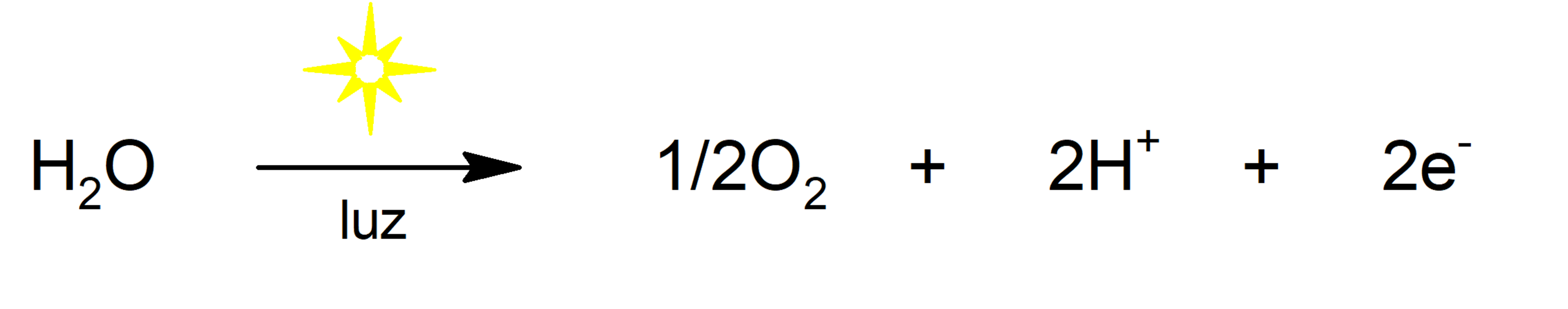
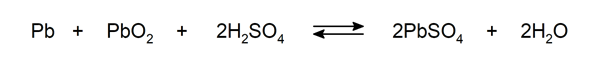
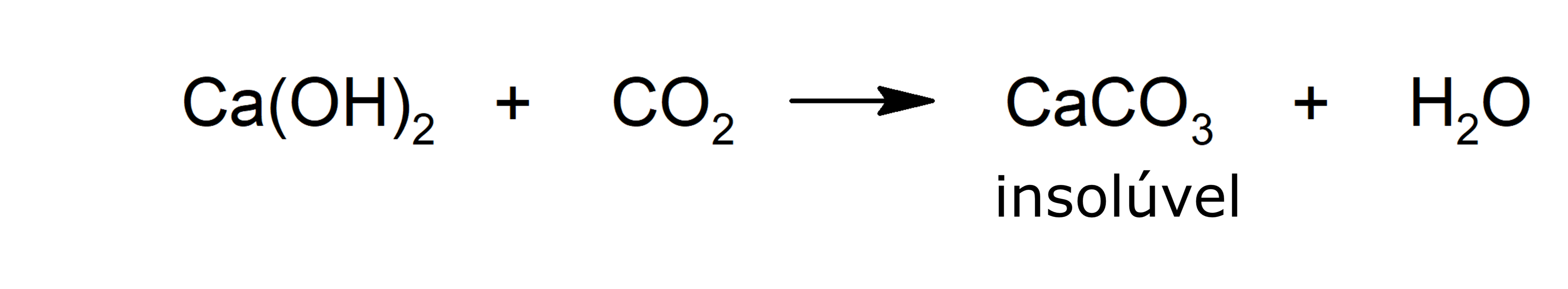
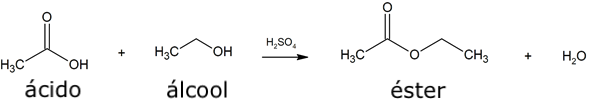

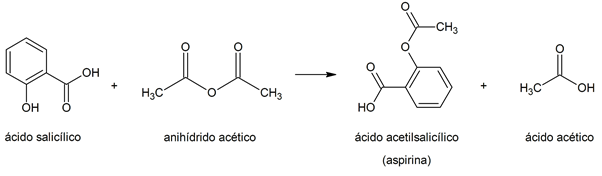
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)