Na química inorgânica, chama-se sais a compostos que são obtidos quando um ácido tem seus átomos de hidrogênio substituídos por catiões (ou cátions) metálicos (embora às vezes por catiões não metálicos, por exemplo, catião amônio, NH4+). No caso específico dos sais ácidos, os hidrogênios do ácido são parcialmente substituídos, ou seja, pelo menos um hidrogênio não substituído permanece no sal. Aqui, distinguem-se dos sais neutros, onde os hidrogênios do ácido são completamente substituídos.
Os sais são geralmente formados através da reação entre um ácido e um hidróxido (base). Nestas reações, a base perde normalmente os seus grupos hidroxila (–OH) e o ácido os átomos de hidrogênio (H), formando um sal neutro; mas se o ácido em questão conserva pelo menos um dos seus átomos de hidrogênio, alterando a carga elétrica da reação, obtemos um sal ácido ou hidrogenado.
Obtém-se dessa forma, por exemplo, bicarbonato de lítio e água a partir da reação entre o hidróxido de lítio e o ácido carbônico:
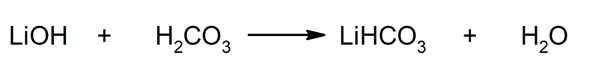
- Veja também: Hidrácidos
Nomenclatura dos sais ácidos
Os sais ácidos podem ser nomeados de acordo com os três tipos de nomenclatura mais comuns:
- Nomenclatura Tradicional. O sal é nomeado como sendo neutro, mas a palavra “ácido” é colocada antes do nome do metal ou do prefixo (bi-) antes do nome do sal. Por exemplo: carbonato ácido de lítio ou bicarbonato de lítio (LiHCO3).
- Nomenclatura Stock. O sal é referido como sendo neutro, mas coloca-se antes no seu nome a palavra “hidrogênio”. Por exemplo: hidrogênio carbonato de lítio (LiHCO3).
- Nomenclatura Sistemática. O sal é nomeado colocando a palavra “hidrogênio” seguido do prefixo que indica a quantidade de oxigênios (di, tri-, tetra-), em seguida, coloca-se a palavra “oxo” seguido do nome do anião do sal como se fosse neutro indicando em números romanos e entre parênteses o número de oxidação do não metal que compõe seu anião, finalmente se coloca ‘de nome do metal’. Por exemplo: hidrogênio trioxocarbonato (IV) de lítio (LiHCO3).
Exemplos de sais ácidos
- Bicarbonato de sódio (NaHCO3). Também denominado hidrogenocarbonato de sódio (IV), é um sólido cristalino de cor branca, solúvel em água, que pode ser encontrado na natureza, no estado mineral ou pode ser produzido em laboratório. É um dos sais ácidos mais conhecidos e é amplamente utilizado em confeitaria, farmacologia ou elaboração de iogurte.
- Bicarbonato de lítio (LiHCO3). Este sal ácido foi utilizado como agente de captura de CO2 em situações em que o gás é indesejável, como nas missões espaciais americanas “Apolo”.
- Dihidrogenofosfato de potássio (KH2PO4). É um sólido cristalino, inodoro, solúvel em água, amplamente utilizado em diversas indústrias como fermento de alimentos, agente quelante, fortificador nutricional e ajuda nos processos de fermentação.
- Bissulfato de sódio (NaHSO4). É um sal ácido formado pela neutralização do ácido sulfúrico. É muito utilizado industrialmente na refinação de metais e produtos de limpeza. Embora seja altamente tóxico para alguns equinodermos, é utilizado como aditivo na alimentação dos animais de estimação e na fabricação de joias.
- Hidrogenossulfureto de sódio (NaHS). É um composto perigoso de manipulação delicada, pois é altamente corrosivo e tóxico. Pode causar queimaduras graves na pele e lesões oculares graves, uma vez que também é combustível.
- Hidrogenofosfato de cálcio (CaHPO4). É empregado como suplemento dietético em cereais para gado. É um sólido insolúvel na água, mas capaz de cristalizar ao ser hidratado consumindo duas moléculas de água.
- Hidrogenocarbonato de amônia ([NH4]HCO3). Também conhecido como “bicarbonato de amônia” é empregado na indústria alimentícia como fermento químico, embora tenha a desvantagem de pegar a amônia e imprimir mau sabor às comidas se usado em excesso. Também é usado em extintores de incêndio, processamento de pigmentos e para expandir a borracha.
- Bicarbonato de bário (Ba[HCO3]2). É um sal ácido que ao ser aquecido pode reverter sua reação de produção e que é altamente instável, exceto em solução. É muito utilizado na indústria cerâmica.
- Bissulfito de sódio (NaHSO3). Este sal é extremamente instável e, na presença de oxigênio, deriva em sulfato de sódio (Na2SO4), por isso é utilizado na indústria alimentícia como conservante e dessecante de alimentos. É um agente redutor extremo e de uso comum pelo homem, usado também na fixação das cores.
- Citrato de cálcio (Ca3[C6H5O7]2). Comumente conhecido como sal amargo, é utilizado como conservante alimentar e como um complemento nutricional quando ligado ao aminoácido lisina. É um pó cristalino, inodoro, branco.
- Fosfato monocálcico (Ca[H2PO4]2). É um sólido incolor que se obtém da reação de hidróxido de cálcio e ácido fosfórico, muito empregado como agente levedante ou como fertilizante em trabalhos do agro.
- Fosfato dicálcico (CaHPO4). Também conhecido como monohidrogênio fosfato de cálcio, possui três diferentes formas cristalinas que se empregam como aditivo nas comidas e está presente nos cremes dentais. Além disso, forma-se naturalmente nos cálculos renais e na chamada “pedra renal”.
- Fosfato monomagnésio (MgH4P2O8). É um sal branco, cristalino e inodoro, parcialmente solúvel em água. É utilizado na preservação de alimentos, como acidulante, como corretor de acidez ou agente no tratamento das farinhas.
- Diacetato de sódio (Nah[C2H3O2]2). Este sal é utilizado como aromatizante e agente conservador das refeições, que impede ou atrasa o aparecimento de fungos e microbactérias, tanto em produtos embalados a vácuo como produtos à base de carne e na indústria das farinhas.
- Bicarbonato de cálcio (Ca[HCO3]2). É um sal hidrogenado que se origina a partir do carbonato de cálcio, presente em minerais como o calcário, o mármore e outros. Esta reação envolve a presença de água e CO2, por isso pode ocorrer espontaneamente em grutas e cavernas ricas em cálcio.
- Ácido fluorídrico (RbHF). Este sal é obtido a partir da reação do ácido fluorídrico (hidrogênio e flúor) e rubídio, um metal alcalino. O resultado é um composto tóxico e corrosivo que deve ser manuseado com precaução.
- Fosfato monoamônico ([NH4]H2PO4). É um sal solúvel na água produzido pela reação da amônia e do ácido fosfórico. É geralmente utilizado como fertilizante, uma vez que fornece ao solo os nutrientes de nitrogênio e fósforo necessários para o crescimento das plantas. Também faz parte do pó ABC dos extintores de incêndio.
- Ortoborato hidrogênio de zinco (Zn[HBO3]). É um sal utilizado como antisséptico e como componente na elaboração das cerâmicas.
- Fosfato monossódico (NaH2PO4). É mais usado em laboratórios, como “buffer” ou tampão, que previne mudanças bruscas no pH de uma solução.
- Hidrogenoftalato de potássio (KHP). Também chamado de “ftalato ácido de potássio”, é um sal sólido e estável no ar normal, por isso é muitas vezes usado como padrão a ser seguido primeiramente em medições de pH. Também é útil como agente tampão (ou agente tamponador) em reações químicas.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)