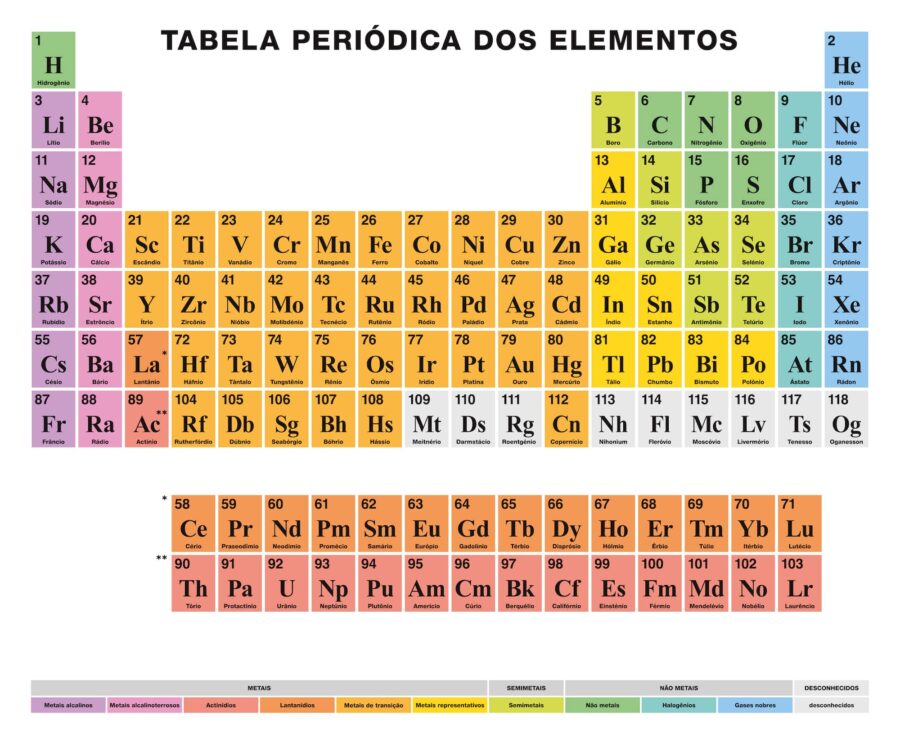
A Tabela Periódica dos elementos é uma tabela na qual se encontram dispostos todos os elementos químicos conhecidos pelo homem, organizados segundo seu número atômico (quantidade de prótons), configuração de elétrons e propriedades químicas específicas.
Trata-se de uma ferramenta conceitual fundamental para o estudo da matéria, cuja primeira versão foi publicada em 1869 pelo químico russo Dmitri Mendeleev, e que foi atualizada ao longo dos anos, à medida que novos elementos químicos são descobertos e os padrões subjacentes às suas propriedades melhor compreendidos.
A Tabela Periódica atual está estruturada em sete filas (horizontais) denominadas períodos e em 18 colunas (verticais), denominadas grupos ou famílias. Os elementos químicos são organizados de acordo com as suas propriedades da esquerda para a direita ao longo dos períodos e de cima para baixo, seguindo cada grupo.
Algumas propriedades dos elementos químicos, como o rádio atômico e o rádio iônico, aumentam de cima para baixo (seguindo o grupo) e da direita para a esquerda (seguindo o período), enquanto a energia de ionização, a afinidade eletrônica e a eletronegatividade aumentam de baixo para cima (seguindo o grupo) e da esquerda para a direita (seguindo o período).
- Veja também: Compostos orgânicos e inorgânicos
Grupos da Tabela Periódica
Numerados de 1 a 18, da esquerda para a direita, os nomes atuais dos grupos são determinados pela nomenclatura IUPAC, aprovada em 1988 para unificar as diversas formas de nome que existiam. Os elementos integrantes de cada grupo têm configurações eletrônicas semelhantes e a mesma valência (quantidade de elétrons na última órbita), por isso têm propriedades químicas semelhantes.
Segundo a IUPAC, existem os seguintes grupos de elementos:
- Grupo 1 (Família 1 A). Neste grupo estão todos os metais alcalinos, com exceção do hidrogênio, que, embora nominalmente no grupo, é um gás. Fazem parte da família os elementos: lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs), frâncio (Fr). Possuem densidades muito baixas, são bons transmissores do calor e de eletricidade, e jamais é encontrado livremente na natureza, mas em compostos com outros elementos.
- Grupo 2 (Família 2A). Neste grupo estão os chamados metais alcalino-terrosos, são mais duros que os alcalinos, brilhantes e bons condutores elétricos, ainda que menos reativos e muito bons redutores (oxidantes). A família é composta por berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra).
- Grupo 3 (Família 3B). Neste grupo está a família do escândio, embora em muitos dos grupos do bloco “d” da tabela (grupos de 3 a 12, incluindo os actinídeos e as terras raras) não haja consenso definitivo sobre a organização ideal. Compõem esta família: o escândio (Sc), ítrio (Y), lantânio ou lutécio (La) e actínio (Ac), são sólidos, brilhantes e altamente reativos, semelhantes em propriedades ao alumínio. A este grupo pertencem também as chamadas “terras raras”: os lantanídeos (ou lantanoides). Os actinídeos (ou actinoides), também pertencem a este grupo. Ambos os conjuntos de elementos (lantanídeos e actinídeos) são denominados “elementos de transição interna” e estão em um bloco inferior da tabela. Os lantanídeos são: o lantânio (La), cério (Ce), praseodímio (Pr), neodímio (Nd), promécio (Pm), samário (Sm), európio (Eu), gadolínio (Gd), térbio (Tb), disprósio (Dy), holmio (Ho), érbio (Er), túlio (Tm), itérbio (Yb), lutécio (Lu). Os actinídeos são: o actínio (Ac), tório (Th), protactínio (Pa), urânio (U), neptúnio (Np), plutônio (Pu), amerício (Am), cúrio (Cm), berquélio (Bk), califórnio (Cf), einstênio (Es), férmio (Fm), mendélevio (Md), nobélio (No) e laurêncio (Lr). A partir do neptúnio, trata-se de isótopos instáveis criados pelo homem.
- Grupo 4 (Família 4B). Neste grupo está a chamada “família do titânio”, composta por elementos de titânio (Ti), zircônio (Zr), háfnio (Hf) e rutherfórdio (Rf), este último sintético e radioativo, de modo que, às vezes, não é levado em conta. Trata-se de metais altamente reativos, por isso, em certas apresentações, podem se tornar imediatamente vermelhos e inflamados apenas por contato com o oxigênio do ar.
- Grupo 5 (Família 5B). Neste grupo está a família do vanádio (V), encabeçada pelo vanádio (V) e acompanhada pelo nióbio (Nb), tântalo (Ta) e dúbnio (Db), este último de produção exclusiva nos laboratórios. São sólidos à temperatura ambiente, de cor prateada e conduzem o calor e a eletricidade.
- Grupo 6 (Família 6B). Neste grupo está a família do cromo (Cr), composta pelo cromo (Cr), molibdênio (Mo), tungstênio (W) e seabórgio (Sg). São sólidos de alto ponto de fusão e ebulição, condutores de calor e eletricidade, muito resistentes à corrosão e bastante reativos.
- Grupo 7 (Família 7B). Nesta família se encontram o manganês (Mn), tecnécio (Tc) e rênio (Re), bem como o elemento de número atômico 107, o bóhrio (Bh). Este último foi sintetizado pela primeira vez em 1981 e é altamente instável, de modo que sua vida média é de apenas 0,44 segundos. Em linhas gerais, o rênio e o tecnécio também são elementos extremamente raros: o tecnécio não tem formas estáveis, enquanto o manganês é muito comum na natureza.
- Grupo 8 (Família 8B). Neste grupo está a família do ferro (Fe), que inclui o rutênio (Ru), o ósmio (Os) e o hássio (Hs). O hássio era conhecido como ununóctio e foi sintetizado em 1984 pela primeira vez; figura entre os controversos elementos 101 a 109, cuja nomenclatura foi questionada. São elementos bastante reativos, bons condutores de calor e eletricidade e, no caso do ferro, magnéticos.
- Grupo 9 (Família 8B). Neste grupo está a família do cobalto (Co), que contém os elementos cobalto (Co), ródio (Rh), irídio (Ir) e meitnério (Mt). Tal como no grupo anterior, o primeiro é ferromagnético e representativo das propriedades da família, e o último é sintético, por isso não existe na natureza (o seu isótopo mais estável dura cerca de 10 anos).
- Grupo 10 (Família 8B). Em versões anteriores da Tabela Periódica, este grupo integrava uma só família, com os grupos 8 e 9. Versões recentes os separaram. Este grupo é liderado pelo níquel (Ni), que acompanha o paládio (Pd), platina (Pt) e darmstádtio (Ds). São metais comuns na natureza em forma elementar, embora o níquel (o mais reativo) possa ser encontrado em liga (em alguns meteoritos, sobretudo). Suas propriedades catalíticas fazem destes metais um fornecimento importante para a indústria química e aeroespacial.
- Grupo 11 (Família 1B). Neste grupo está a família do cobre (Cu), e a integram o cobre (Cu) e os metais preciosos como o ouro (Au) e a prata (Ag) e ainda o roentgênio (Rg). Também são conhecidos como “metais de cunhar”. São pouquíssimos reativos, difíceis de corroer, moles e sumamente úteis ao homem.
- Grupo 12 (Família 2B). Este grupo contém a família do zinco (Zn), que contém o zinco, cádmio (Cd), mercúrio (Hg) e o copernício (Cn), anteriormente denominado unúnbio. São metais moles (na verdade, o mercúrio é o único metal líquido à temperatura ambiente), diamagnéticos e divalentes, com os pontos de fusão mais baixos de todos os metais de transição. O curioso é que o zinco é muito necessário para a química da vida, enquanto o cádmio e o mercúrio são altamente intoxicantes. O copernício, por sua vez, é um elemento sintético criado em 1996.
- Grupo 13 (Família 3A). Neste grupo estão os elementos conhecidos como “terrosos”, já que são abundantes na terra, sobretudo o alumínio. O grupo é liderado pelo boro (B), que é um metaloide, e depois o alumínio (Al), gálio (Ga), indiano (In), tálio (Ta) e nihônio (Nh), cada vez mais metálicos à medida que desce na coluna. E embora o boro possua alta dureza e propriedades não metálicas, os outros são metais moles e maleáveis muito usados pelo homem.
- Grupo 14 (Família 4A). Neste grupo estão os elementos carbonoides, encabeçados pelo carbono (C), e continuando com o silício (Si), germânio (Ge), estanho (Sn), chumbo (Pb) e fleróvio (Fl). São elementos muito conhecidos, especialmente o carbono, indispensável para toda a química da vida. À medida que se desce na família, porém, os elementos vão adquirindo propriedades metálicas, a ponto de que o carbono é não metálico, o silício e germânio semimetais e os últimos claramente metálicos.
- Grupo 15 (Família 5A). Neste grupo estão os elementos nitrogenoides, liderados pelo nitrogênio (N), depois o fósforo (P), arsênico (As), antimônio (Sb), bismuto (Bi) e o moscóvio (Mc), um elemento sintético. Também conhecidos como psicógenos ou nitrogenoides, são altamente reativos a altas temperaturas e muitos são indispensáveis para a química orgânica.
- Grupo 16 (Família 6A). Neste grupo estão os chamados calcógenos ou anfígenos. Trata-se da família do oxigênio (O), que contém o oxigênio (O), seguido pelo enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e livermório (Lv). Caracterizam-se por ter seis elétrons de valência, apesar de que suas propriedades variam de não metálico a metálico, segundo o aumento de seu número atômico. À temperatura ambiente, o oxigênio é um gás muito reativo devido ao seu pequeno tamanho, enquanto o resto dos elementos são sólidos e menos frequentes na natureza.
- Grupo 17 (Família 7A). Neste grupo está a família dos halogênios, nome que provém da sua tendência a formar sais (halogenetos). Isto deve-se ao fato de constituírem geralmente moléculas diatômicas de potência oxidante considerável, o que as leva a constituir íons mononegativos. São amplamente utilizados na indústria química e na fabricação de insumos para laboratório. Estes elementos são flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At) e tenesso (Ts), sendo este último também um metal do grupo f.
- Grupo 18 (Família 8A). Neste grupo estão os elementos conhecidos como “gases nobres” ou “gases inertes”. São elementos de baixíssima reatividade, que costumam se achar como gases monoatômicos, inodoros, incolores, insípidos, formando pouquíssimos e excepcionais compostos, devido a que sua camada mais externa de elétrons está completa. Estes elementos são o hélio (He), neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe), radônio (Rn) e oganessônio (Og). Estes dois últimos são especiais: o radônio é radioativo e não possui isótopos estáveis (seu isótopo mais estável é o 222Rn, que existe apenas 3,8 dias), enquanto o oganessônio é de origem sintética e o elemento mais pesado criado até hoje.
Blocos da Tabela Periódica
Outra forma de entender a Tabela Periódica é através de seus quatro blocos:
- Bloco s. Compreende os dois primeiros grupos, ou seja, metais alcalinos e alcalino-terrosos, além do hidrogênio e do hélio.
- Bloco p. Compreende os últimos seis grupos, ou seja, de 13 a 18, além disso a todos os metaloides.
- Bloco d. Compreende os grupos de 3 a 12 e todos os metais de transição.
- Bloco f. Inclui as terras raras (lantanídeos) e os actinídeos. Não possui números de grupo próprios, embora se suponha que estes elementos pertenceriam ao grupo 3.
- Bloco g. Um bloco hipotético, no qual seriam colocados os elementos que consigam ser sintetizados no futuro.
Continue com:
Esta informação foi útil para você?
Sim NãoGenial! Obrigado por nos visitar :)