La difusión es un proceso físico que se basa en el flujo de partículas de una especie química desde una región de mayor concentración de esta especie hacia una región de menor concentración. Este proceso ocurrirá hasta que la concentración en ambas regiones sea la misma.
Por lo general, la difusión ocurre en líquidos y gases. Por ejemplo, el aroma de una comida al ingresar a una habitación es consecuencia de la difusión de una mezcla de dos gases, es decir, las partículas gaseosas de la comida (el aroma) penetran en la habitación, que inicialmente solo contenía aire. De este modo, se difunden hasta que la concentración de estas partículas es la misma afuera y adentro de la habitación.
Algunas características de una difusión:
- Se produce desde una concentración mayor en soluto hacia una zona de concentración menor en soluto.
- Es un proceso gradual, ya que las partículas de la sustancia que se difunde pueden sufrir diversas modificaciones mientras ocurre el proceso. Además, es un tipo de transporte pasivo, es decir, no es necesario aplicar energía externa para que ocurra.
- La rapidez de la difusión dependerá de la masa y el tamaño de las partículas de cada sustancia. Hay gases pesados cuya difusión es más lenta y otros (gases más livianos) cuya difusión es más rápida.
Ejemplos de difusión

- El perfume de las flores en un sitio cerrado.
- Un aroma que se esparce por toda una habitación.
- Una persona perfumada que ingresa en una habitación y todos pueden oler su perfume.
- El humo que desprenden los automóviles en circulación.
- El humo de las chimeneas de los hogares o fábricas.
- El olor de un alimento en descomposición dentro de la nevera.
- El olor de una vela aromática, incienso o cerilla.
- El humo de un cigarrillo en una habitación hermética.
- Las esencias aromáticas.
- El olor de un huevo podrido dentro de un recipiente.
La efusión
La efusión es el proceso mediante el cual un gas escapa al exterior de un recipiente a través de una pequeña abertura o grieta. La velocidad de efusión es directamente proporcional a la velocidad media de las partículas del gas.
Esto quiere decir que si una molécula de gas pesado presenta una efusión, lo hará de forma más lenta que una molécula de gas más liviano, en cuyo caso la efusión será de modo más rápido. Por ejemplo: balón desinflado.
La Ley de Graham
Si las condiciones de presión y temperatura son iguales, la velocidad de difusión y efusión de los gases es inversamente proporcional a las raíces cuadradas de sus masas molares.
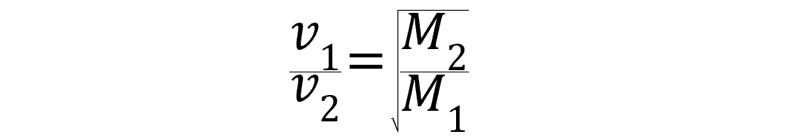
Siendo v1 y v2 las velocidades de los gases 1 y 2 expresadas en metros por segundo (m/s), y M1 y M2 las masas molares de los gases 1 y 2 expresadas en kilogramos por mol (kg/mol).
Ejemplos de efusión

- Oprimir el botón de un desodorante.
- Girar la perilla de una hornalla para encenderla o apagarla.
- Un recipiente de helio con una fuga.
- Un globo aerostático que presenta una pérdida.
- Las mochilas a propulsión.
- Los tubos de gas de los astronautas.
- Un globo desinflándose.
- Una flatulencia.
- La separación de uranio-238 en uranio-235-
- Un cilindro de gas con una pequeña fuga por el cual este gas se desplaza hacia otro compartimento o hacia el exterior.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)