Índice
Un haluro o halogenuro es un compuesto químico binario que está formado por un átomo de un halógeno y un elemento o catión que tiene una electronegatividad menor que la del halógeno. Por ejemplo:
- Cloruro de sodio (NaCl)
- Fluoruro de calcio (CaF2)
- Bromuro de potasio (KBr)
- Cloruro de hidrógeno (HCl(g))
Los halógenos son los elementos químicos que componen el grupo 17 de la Tabla Periódica. Los halógenos son: Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), Astato (At), Teneso (Ts).
Tipos de haluros
Según su composición, los haluros pueden ser:
- Haluros inorgánicos. Son compuestos químicos inorgánicos que contienen uno o varios átomos de un halógeno. Pueden ser sales inorgánicas, haluros de hidrógeno o complejos metálicos. Por ejemplo: el cloruro de sodio (NaCl) y el anión tetrayodomercurato HgI42-.
- Haluros orgánicos. Son compuestos químicos orgánicos que contienen uno o varios átomos de un halógeno unido a un átomo de carbono de un compuesto orgánico. Por ejemplo: el cloruro de metilo (CH3 – Cl) y el triclorometano (CH – Cl3).
Ejemplos de haluros
- Cloruro de sodio (NaCl)
- Cloruro de calcio (CaCl2)
- Fluoruro de plata (AgF)
- Fluoruro de litio (LiF)
- Yoduro de potasio (KI)
- Bromuro de potasio (KBr)
- Cloruro de cobre (II) (CuCl2)
- Cloruro de hierro (III) (FeCl3)
- Bromuro de cromo (III) (CrBr3)
- Cloruro de aluminio (AlCl3)
- Cloruro de amonio ((NH4)Cl)
- Yoduro de plomo (II) (PbI2)
- Yoduro de magnesio (MgI2)
- Fluoruro de berilio (BeF2)
- Fluoruro de aluminio (AlF3)
- Bromometano (CH3 – Br)
- Yodoformo (CHI3)
- Cloruro de metilo (CH3 – Cl)
- Bromoetano (CH3 – CH2 – Br)
- Dicloroetano (Cl – CH2 – CH2 – Cl)
- Bromuro de plata (AgBr)
- Cloruro de estaño (IV) (SnCl4)
- Cloruro de titanio (IV) (TiCl4)
- Cloruro de hidrógeno (HCl(g))
- Bromuro de hidrógeno (HBr(g))
Propiedades físicas de los haluros
Algunas de las propiedades físicas de los haluros son:
- Los haluros de alquilo (haluros orgánicos) presentan densidades y puntos de ebullición más elevados que los de sus alcanos correspondientes. Esto ocurre porque tiene mayor peso el átomo de halógeno que ha sustituido a un átomo de hidrógeno en el hidrocarburo del cual proviene el haluro.
- Los fluoruros y cloruros orgánicos son menos densos que el agua, mientras que los bromuros y yoduros orgánicos son más densos que el agua.
- Los haluros de alquilo son insolubles en agua y solubles en solventes orgánicos.
- Los haluros de hidrógeno son gases de olor intenso a temperatura ambiente.
- Los haluros formados con los átomos de los elementos del grupo 1 de la Tabla Periódica son sólidos blancos.
Propiedades químicas de los haluros
- Los haluros de alquilo experimentan reacciones de sustitución nucleofílica alifática. Se trata de reacciones en las que un átomo nucleófilo (rico en electrones) sustituye a un átomo (grupo saliente) que está unido a un átomo electrófilo (deficiente de electrones).
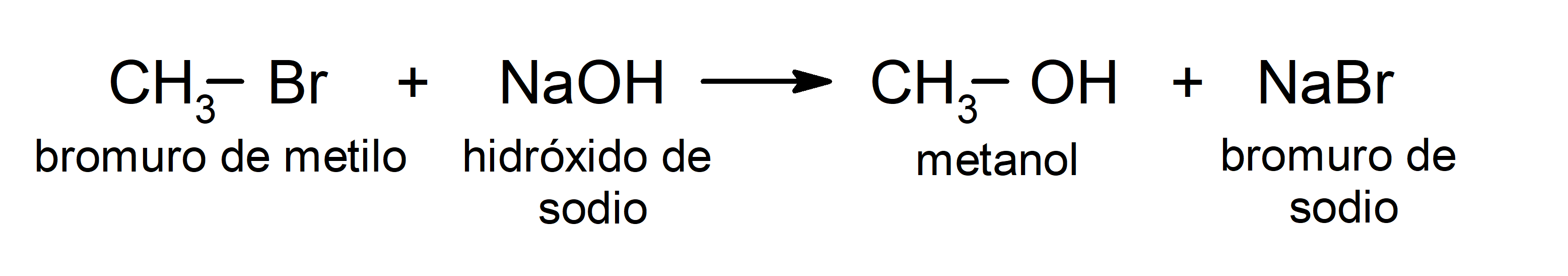
Por ejemplo: en la reacción del bromuro de metilo (CH3 – Br) con el hidróxido de sodio (NaOH), el bromo (grupo saliente) es sustituido por el ion hidróxido (nucleófilo) en el bromuro de metilo, donde el carbono es el electrófilo.
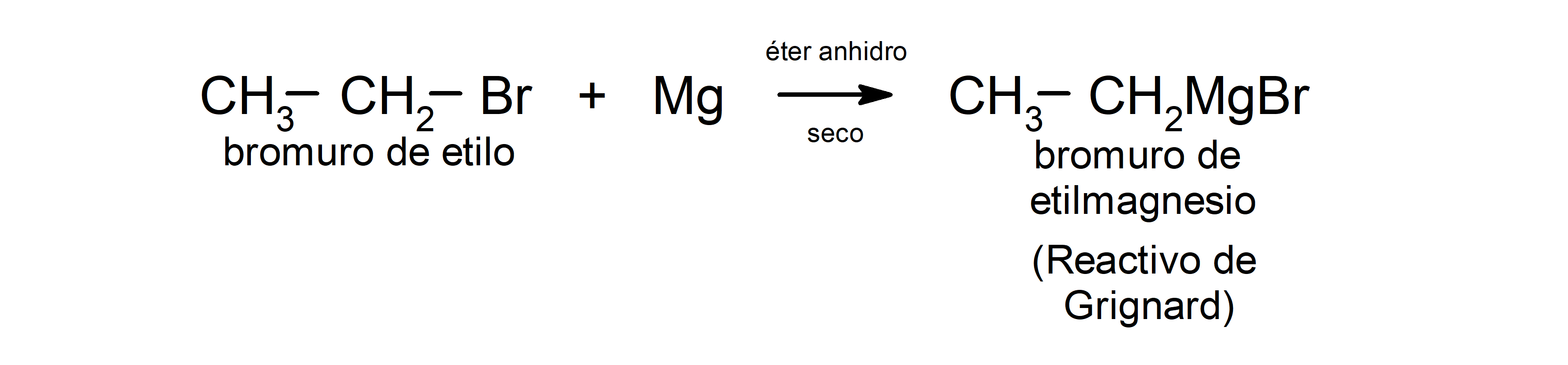
- Algunos halogenuros de alquilo reaccionan con magnesio en solventes como éter o tetrahidrofurano, y el producto resultante es un compuesto organometálico llamado “reactivo de Grignard”. Por ejemplo: el bromuro de etilo (CH3 – CH2 – Br) con magnesio (Mg) reacciona en un medio seco para producir bromuro de etilmagnesio (CH3 – CH2 – MgBr).
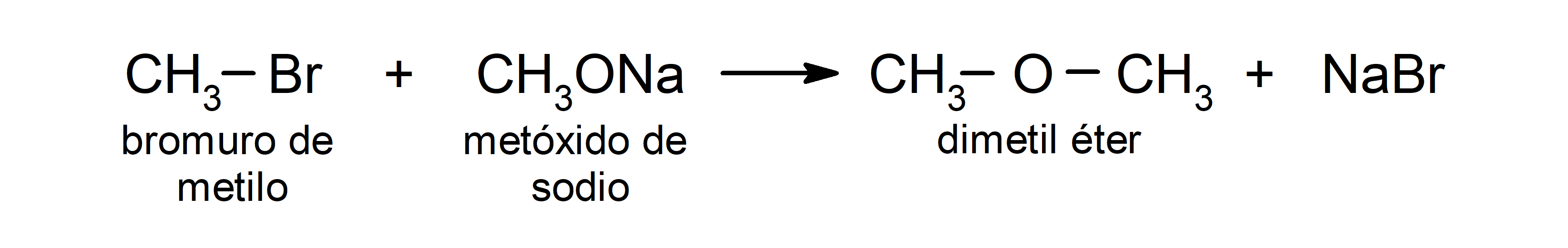
- Los halogenuros de alquilo primarios experimentan reacciones con alcóxidos o alcoholes en medio básico para producir éteres. Estas reacciones se conocen como “síntesis de Williamson”. Por ejemplo: la reacción entre el bromuro de metilo (CH3Br) y el metóxido de sodio (CH3ONa) produce dimetil éter (CH3OCH3).
Usos de los haluros
Los haluros o halogenuros tienen diversas aplicaciones en la industria, en la medicina y en la vida cotidiana. Algunas de estas aplicaciones son:
- Se utilizan como disolventes de muchos compuestos orgánicos.
- Se emplean como desinfectantes y antisépticos.
- Se han usado como refrigerantes.
- Se utilizan en la fabricación de polímeros fluorados. Por ejemplo, el teflón.
- Se emplean como sales comestibles o tinturas en medicina.
- Se usan en el tratamiento y la potabilización del agua.
- Los haluros metálicos se utilizan en la fabricación de lámparas.
- Se emplean en la limpieza de componentes electrónicos.
- Se utilizan como compuestos químicos de partida para sintetizar compuestos orgánicos más complejos.
- Algunos, como el bromuro de plata (AgBr), se usan en el revelado de placas fotográficas.
Peligros de los haluros
Los haluros de alquilo que se emplean como solvente reaccionan violentamente con bases fuertes y oxidantes fuertes, lo que puede generar explosiones e incendios.
Además, los clorofluorocarburos (CFCs) son haluros de alquilo que se han empleado por décadas como refrigerantes, pero su empleo ha sido prohibido por entes internacionales debido a que son los principales responsables del agujero en la capa de ozono.
Por otra parte, los haluros de hidrógeno son irritantes para los ojos, la piel y las mucosas.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)