Índice
Una reacción endotérmica es una reacción que absorbe energía del medio en forma de calor. En estas reacciones, para que los reactivos se transformen en productos, es necesario que absorban calor, lo que genera que los productos tengan mayor energía que los reactivos que les dieron origen. Algunos ejemplos de reacciones endotérmicas son: la fotosíntesis y la electrólisis del agua.
Ejemplos de reacciones endotérmicas en la vida cotidiana
Algunas de las principales reacciones endotérmicas son:
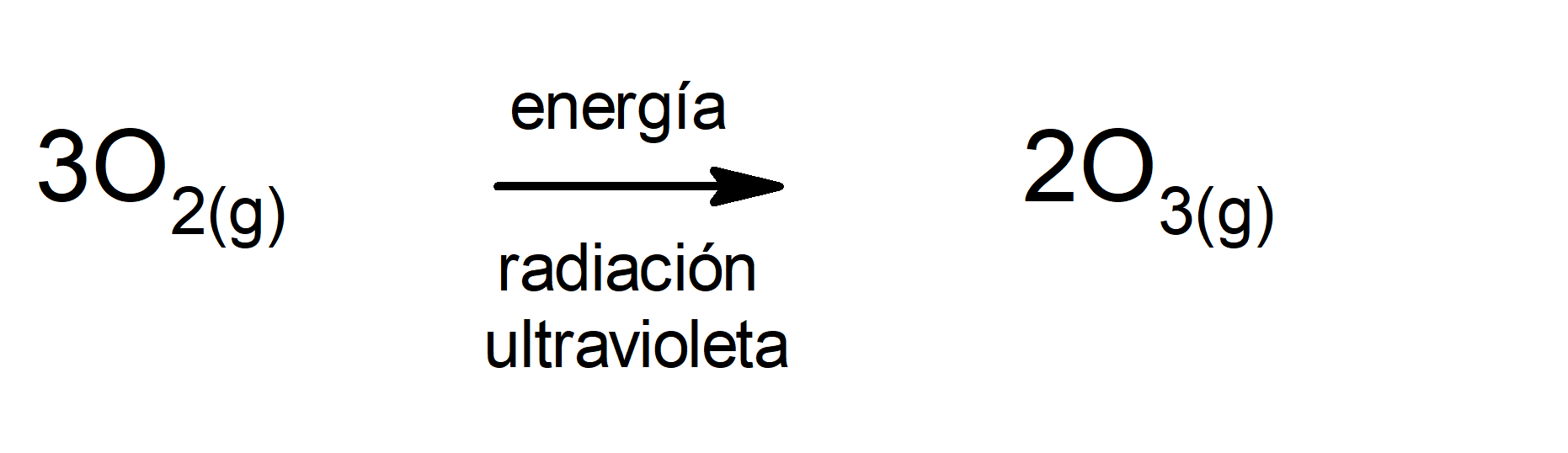
Producción del ozono en la atmósfera. El ozono se produce en la atmósfera cuando el oxígeno molecular (O2) absorbe radiación ultravioleta y se rompe. Luego un átomo de oxígeno (O) puede interactuar con otra molécula de oxígeno (O2) y formar el ozono (O3).
Electrólisis del agua. Es el proceso mediante el cual se aplica energía eléctrica al agua para separarla en sus dos componentes, hidrógeno (H) y oxígeno (O).
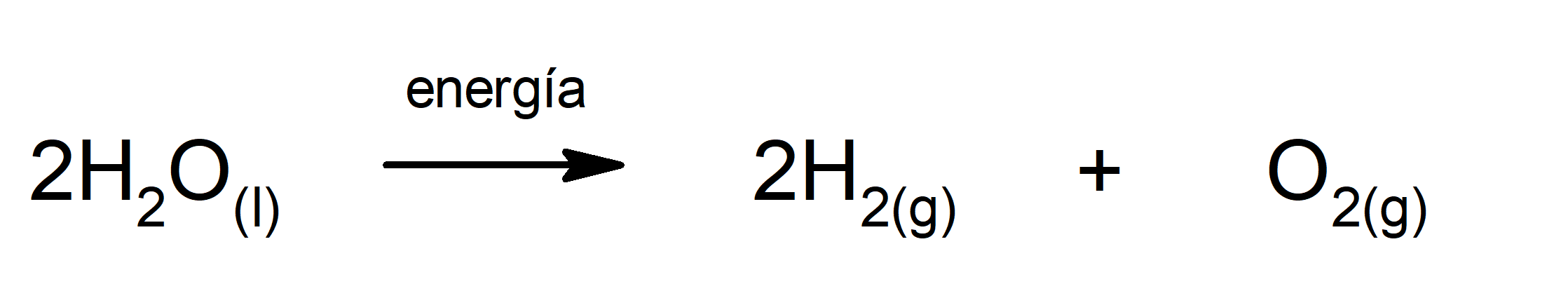
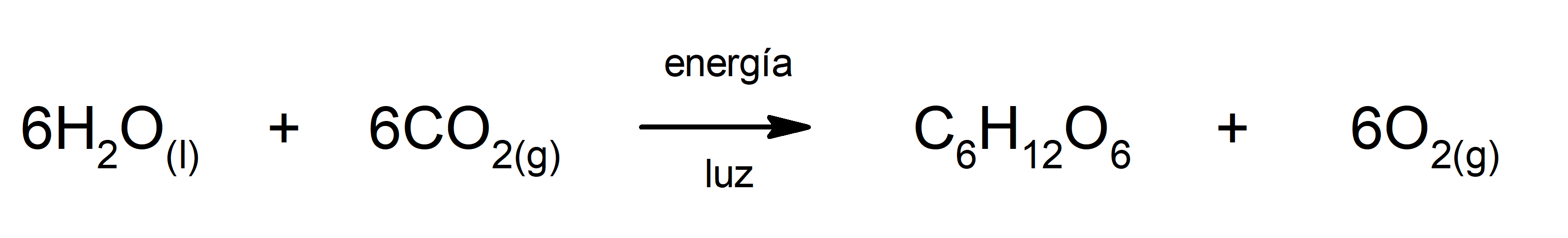
Fotosíntesis. Es la reacción química mediante la cual, absorbiendo energía solar, el dióxido de carbono (CO2) se transforma en glucosa. Esta reacción constituye la principal vía de nutrición de las plantas.
Producción de sulfuro de hierro (II). Para que ocurra la reacción entre el azufre y el hierro es necesario aportar energía en forma de calor.
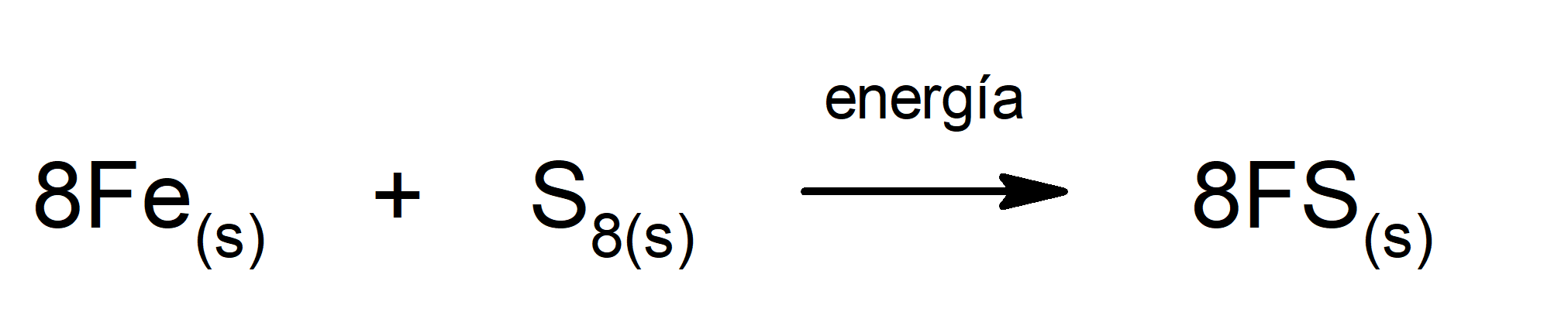
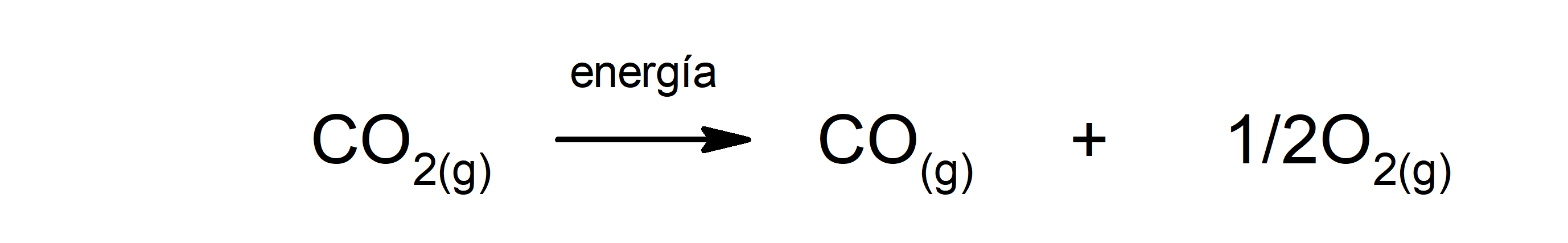
Descomposición del dióxido de carbono (CO2). La descomposición del CO2 a altas temperaturas produce monóxido de carbono (CO) y oxígeno (O2).
Descomposición del carbonato de calcio (CaCO3). El carbonato de calcio se descompone con absorción de calor para producir óxido de calcio (CaO) y dióxido de carbono (CO2).
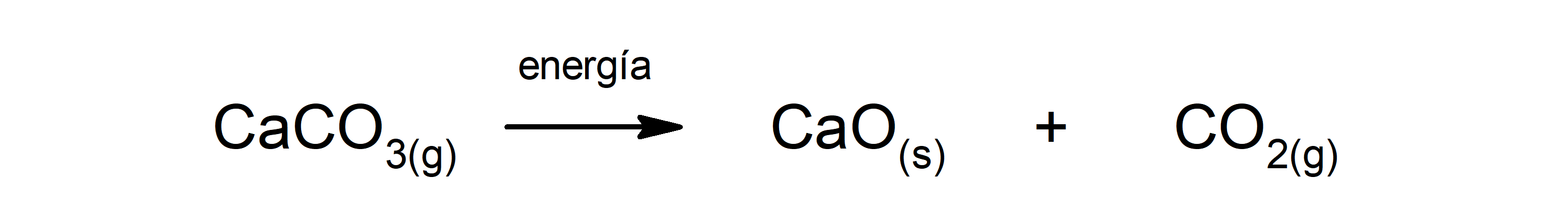
Diferencia entre reacción endotérmica y exotérmica
La principal diferencia entre reacciones endotérmicas y exotérmicas es que las reacciones endotérmicas absorben calor, mientras que las reacciones exotérmicas liberan calor.
Además, las reacciones endotérmicas están caracterizadas por un aumento de entalpía, mientras que las reacciones exotérmicas están asociadas a una disminución de entalpía.
La entalpía es una magnitud termodinámica que define el flujo de energía térmica a presión constante durante una reacción química. Se representa por la letra H, y su variación es uno de los principales indicadores para definir si una reacción química es endotérmica o exotérmica.
- Si una reacción química tiene variación de entalpía mayor que cero (ΔH > 0) es endotérmica.
- Si una reacción química tiene variación de entalpía menor que cero (ΔH < 0) es exotérmica.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)